Sabemos que nuestro sistema inmunitario es esencial para defendernos de los agentes patógenos que nos atacan. Durante el embarazo, dentro del cuerpo de la madre se desarrolla un organismo nuevo y «extraño». Entonces, ¿Cómo es posible que el sistema inmunitario materno no ataque al feto? En este artículo, exploraremos la llamada tolerancia inmunológica, la tolerancia materno-fetal que explica el funcionamiento del sistema inmune en el embarazo.
Índice de contenido:
El concepto de tolerancia inmunológica
La tolerancia inmunológica se define como la ausencia de respuesta del sistema inmunitario ante un antígeno específico, ya sea propio o extraño. En inmunología, un antígeno se define como cualquier sustancia que introducida en un organismo animal es capaz de activar una respuesta inmune frente a él. La tolerancia inmunológica, Más allá de ser una “simple ausencia” de respuesta, es un proceso estrechamente regulado en el que se impide la activación de la respuesta inmune de forma activa en unas condiciones determinadas. La tolerancia inmunológica se trata de un mecanismo de vital importancia para que nuestro sistema inmunitario sepa distinguir entre nuestro propio cuerpo y los agentes patógenos que nos invadan.
¿Se te ocurren ejemplos en los que los mecanismos de tolerancia inmunológica son esenciales? Probablemente las primeras respuestas que se te vienen a la cabeza son el trasplante de órganos y tejidos o las enfermedades autoinmunes. Éstas últimas se producen por una respuesta de nuestro sistema inmunitario frente a moléculas presentes en nuestros propios tejidos que no son reconocidas como «nuestras», es decir, hay un fallo en los mecanismos de tolerancia inmunológica hacia nuestro propio cuerpo. Sin embargo, ¿Te habías parado a pensar en el embarazo como fenómeno de tolerancia inmunológica?
Teniendo en cuenta que el organismo que se desarrolla en el útero sólo comparte el 50% del material genético con la madre, no es tan descabellado pensar que el sistema inmune en el embarazo pueda reconocer al feto como un “objeto extraño” y activarse para eliminarlo, como si de un patógeno se tratara. Llegados a este punto, te podrás imaginar que existen mecanismos de tolerancia inmunológica que se activan durante la gestación y que son esenciales para que ésta ocurra con éxito. Estos mecanismos de tolerancia podrían dividirse en tres grandes grupos que detallaremos a continuación.
Mecanismos de tolerancia inmunológica durante el embarazo
1. La interfase materno-fetal: la placenta
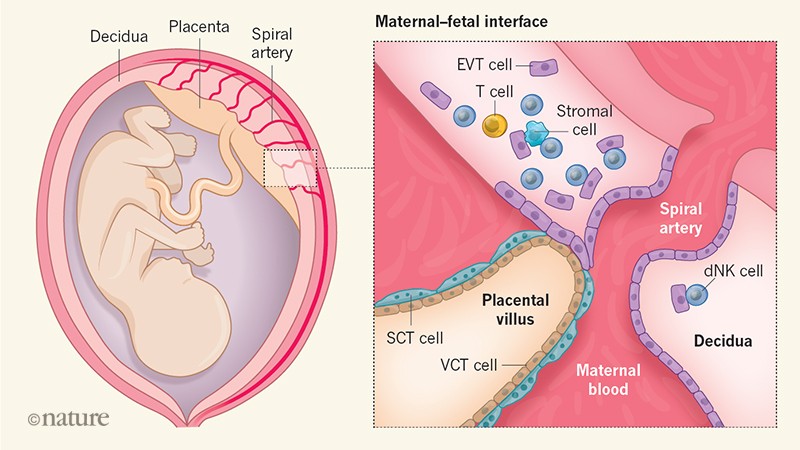
Durante la implantación del embrión, las células de la pared uterina se diferencian a la decidua (nombre que se le da al endometrio durante la gestación, ver figura1). Ésta será invadida por el trofoblasto fetal, una capa delgada de células que cubre el embrión y lo protege durante su desarrollo. Esto provoca la ruptura de los vasos sanguíneos maternos y genera lo que se conoce como circulación uteroplacentaria primitiva, esencial para el aporte de oxígeno y nutrientes al embrión. A continuación, el trofoblasto origina dos capas: el sincitiotrofoblasto y el citotrofoblasto (ver figura 1), que acabarán formando la placenta. Esta interfase forma una barrera física, importante para que el embrión o feto no esté en contacto directo con los tejidos maternos.
2. Evasión inmunológica por parte del feto
2.1. Expresión de moléculas del complejo mayor de histocompatibilidad
Se conocen también como HLA, del inglés Human Leykocyte Antigen. Estas moléculas son esenciales para la presentación de antígenos a los linfocitos, lo que conlleva su posterior activación. En general, ocurre una disminución de estas moléculas en la interfase materno-fetal. A continuación detallaremos algunos de los cambios más importantes, según el tipo de molécula HLA:
– Clásicas:
- HLA de clase I. En general, están presentes en todas las células con núcleo de nuestro organismo, precisamente para cumplir su función de presentar antígenos extraños a nuestros linfocitos. Sin embargo, las moléculas HLA-A/B están ausentes en las células del trofoblasto fetal, disminuyendo así su reconocimiento. Curiosamente, este mecanismo para «esconderse» del sistema inmunitario también es utilizado por ciertas células tumorales y células infectadas. Sin embargo, las células del trofoblasto sí expresan HLA-C de origen tanto materno como paterno. Éstas serán reconocidas por los receptores específicos presentes en las células NK de la madre (del inglés Natural Killer, ya que su principal función es eliminar células infectadas o cancerosas). Existen diversas variantes tanto de las moléculas de HLA-C como de sus receptores, con capacidad activadora o inhibidora. La combinación de ambos juega un papel esencial en el éxito de la gestación, pudiendo originar problemas de fertilidad en la pareja. Por ejemplo, si la madre presenta receptores activadores específicos para la variante del HLA-C que presenta el feto, se dará una respuesta inmunológica que conlleva el rechazo del embarazo. De manera contraria, si la madre presenta receptores inhibidores específicos para la variante del HLA-C del feto, la interacción entre ambos será neutra y permitirá el desarrollo del embrión.
- HLA de clase II. No se expresan ni en el citotrofoblasto ni en la interfase materno-fetal, pero sí en el sincitiotrofoblasto, que es la capa más externa que protege al embrión.
– No clásicas:
Incluyen los HLA-E y HLA-G, también presentes en las células del sincitiotrofoblasto. A diferencia de las moléculas de HLA clásicas, éstas tienen capacidad de presentar una variedad más limitada de antígenos. Su función principal es inhibir la actividad citolítica de células NK y T citotóxicas maternas.
2.2. Inducción de muerte celular de linfocitos maternos
A pesar de que la presencia de moléculas HLA esté reducida, aún pueden haber linfocitos activos que pueden amenazar la integridad del feto. Como consecuencia, las células del trofoblasto expresan el ligando FasL, una molécula que induce la muerte celular de linfocitos maternos activados contra antígenos paternos y que expresan su receptor Fas.
2.3. Depleción de triptófano
El triptófano es un aminoácido esencial para la activación de los linfocitos. Las células del trofoblasto expresan la enzima indoleamina 2,3-dioxigenasa (IDO) que degrada el triptófano, produciendo un agotamiento local. De esta forma, el triptófano dejará de estar disponible en el medio, impidiendo así la activación de los linfocitos. Además, los productos resultantes de esta degradación también pueden frenar la activación e inducir muerte celular de los linfocitos maternos.
3. Baja respuesta del sistema inmunitario materno hacia el feto
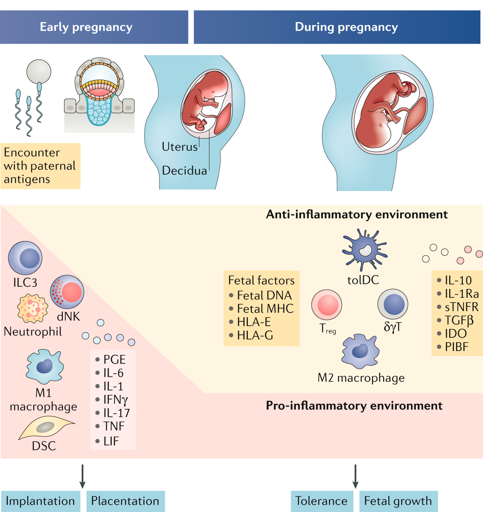
En general, el ambiente inmunitario cambia hacia un entorno tolerogénico debido a la influencia de factores secretados por las células de la decidua durante la implantación, así como de las hormonas sexuales femeninas. La progesterona, producida por la placenta, es una hormona sexual esencial para mantener la tolerancia inmunitaria al feto. Se conoce que esta hormona puede bloquear la respuesta de distintas células inmunitarias y, además, participa en la generación de células T reguladoras, lo que explicaría el proceso de tolerancia inmunológica durante el embarazo.
3.1. Células NK
A pesar de que las NK son células mayoritariamente citolíticas, es decir, con capacidad de inducir muerte celular, existe una subpoblación en el útero con capacidad inmunomoduladora, conocida como células NK uterinas (NKu). Éstas representan el 70-80% de las células linfoides en la decidua durante el embarazo. Desempeñan funciones esenciales de control de la formación de la placenta, mediante su interacción con las moléculas HLA-C/E/G del feto, como se ha comentado anteriormente. Además de inducir tolerancia materno-fetal, tienen un papel importante en la respuesta a infecciones durante el embarazo, como las producidas por el citomegalovirus y que pueden llegar a ser fatales para el feto. Alteraciones en el número de células NKu y NK periféricas se asocian con abortos espontáneos recurrentes (AER).
3.2. Macrófagos
Los macrófagos son el segundo tipo celular inmunitario más abundante, aportando aproximadamente un 20% de las células inmunitarias totales en la decidua. Intervienen en la tolerancia inmunológica durante la implantación y formación de la placenta ocurre un incremento rápido de células para formar los nuevos tejidos, que va acompañado de una gran muerte celular para controlar estos procesos. Los macrófagos son los encargados de eliminar estos restos de células muertas y de producir citoquinas anti-inflamatorias e inmunosupresoras. Además, contribuyen al agotamiento de triptófano mediado por la enzima IDO. En ocasiones, una implantación defectuosa del embrión puede dar lugar a un exceso de muerte celular en el endometrio. En estos casos, la capacidad de eliminar los restos celulares por los macrófagos puede verse sobrepasada, siendo imposible frenar una respuesta pro-inflamatoria que puede acabar con la viabilidad del feto.
3.3. Células T
Las células T representan sólo el 10% de las células inmunitarias totales en la decidua. También son responsables de la tolerancia inmunológica durante el embarazo hay un aumento de linfocitos T reguladores. Éstos, mediante la expresión moléculas inhibidoras en su membrana y secreción de citoquinas anti-inflamatorias, inducen tolerancia inmunológica hacia el feto. De forma similar, los linfocitos T γδ se encuentran aumentados. Éstos controlan el proceso de implantación uterina y también participan en la tolerancia inmunológica hacia el feto mediante la producción de citoquinas anti-inflamatorias. Además, por su actividad citolítica, son esenciales para proteger la unidad materno-fetal frente a patógenos. De forma contraria, los linfocitos T efectores se encuentran disminuidos durante los meses de gestación, sobre todo los de naturaleza pro-inflamatoria, debido a los mecanismos comentados anteriormente.
3.4. Células presentadoras de antígenos
En general son muy poco abundantes en la decidua. Por un lado, las células dendríticas presentan capacidad tolerogénica. Son reclutadas a la interfase materno-fetal, donde responden a estímulos esenciales para la inducción de tolerancia. Mientras que los linfocitos B se encuentran disminuidos durante la gestación a consecuencia de los altos niveles de estrógenos, otra de las hormonas sexuales femeninas implicadas. Al ser poco abundantes, su capacidad de presentar antígenos paternos a las células T de la madre está limitada, ayudando así a la tolerancia al feto.
3.5. Microquimerismo
Se sabe que hay células hematopoyéticas fetales que entran en la circulación materna, las cuales van aumentando a medida que el embarazo progresa y pueden persistir varios años tras el parto. Esto se conoce como microquimerismo, que es la presencia de un pequeño número de células de un individuo en otro individuo huésped, que es genéticamente diferente. Estas células viajarán por el torrente sanguíneo materno hasta llegar a los órganos linfoides secundarios. Allí, al ser pocas en número no se detectarán como una invasión patógena frente a la que el sistema inmunitario debe activarse para eliminarlas, sino todo lo contrario. Los mecanismos de tolerancia inmunológica se activarán, reconociendo las moléculas presentes en estas células ajenas como «propias». De esta forma se podría explicar la inducción de tolerancia inmunológica en la madre frente a antígenos de origen paterno.
Conclusiones
Desde los primeros estudios de Peter Medawar a mediados del siglo XX se han producido numerosos avances en este campo. No obstante, es una materia de estudio compleja. La obtención de tejidos humanos para la investigación no siempre es posible y la rapidez con la que ocurren los cambios durante el desarrollo embrionario dificulta su estudio. ¡Aún quedan muchas incógnitas por resolver! A medida que se conozca mejor la regulación de las vías celulares y moleculares implicadas, podrán manipularse de forma externa para evitar complicaciones y obtener un mayor éxito en las técnicas de reproducción asistida.
Es importante recordar que debe haber un equilibrio entre los mecanismos de tolerancia y de defensa inmunitaria. Los primeros permitirán el desarrollo fetal, mientras que los segundos deberán activarse en el caso de que se produzca una infección durante el embarazo. Alteraciones de ambos darán lugar a complicaciones o incluso un fallo durante la gestación.
Otro dato curioso es que el aumento de estos mecanismos tolerogénicos durante el embarazo en ocasiones mejora determinadas patologías autoinmunes en la madre. Por ejemplo, se han reportado casos de mujeres con artritis reumatoide que mejoran de forma espontánea durante el embarazo y vuelven a empeorar tras el parto. Esto no siempre es así, ni ocurre con todas las enfermedades autoinmunes, pero entrar en detalle daría para otro artículo en el blog. ¡Si quieres saber más házmelo saber en comentarios!
Artículos que pueden interesarte
- ¿Por qué cada vez tenemos menos hijos? Causas de esterilidad
- ¿Qué es el SOP, Síndrome de Ovarios Poliquísticos?
- La memoria del sistema inmune. El baúl de los recuerdos.
- Desgranando el cribado neonatal ¿Está mi bebé sano al nacer?
Referencias
- Malena Cianchetta-Sívori, Manuela Moraru, Áurea García-Segovia, Silvia Sánchez-Ramón. La gestación como fenómeno inmunológico. Revista Iberoamericana Fertilidad y Reproducción humana. 2011; 28(3).
- Barañao RI. Inmunología del embarazo. Invest Clin. 2011;52(2).
- Schjenken JE, Tolosa JM, Paul JW, Clifton VL, Smith R. Mechanisms of maternal immune tolerance during pregnancy. In: Zheng DJ (ed.), Recent Advances in Research on the Human Placenta. Rijeka, Croatia: InTechOpen; 2012: 211–242