¿Conoces los mecanismos comunes a todos los tipos de cáncer? ¿Sabes cuál es el papel de los oncogenes y los protooncogenes en estos procesos?
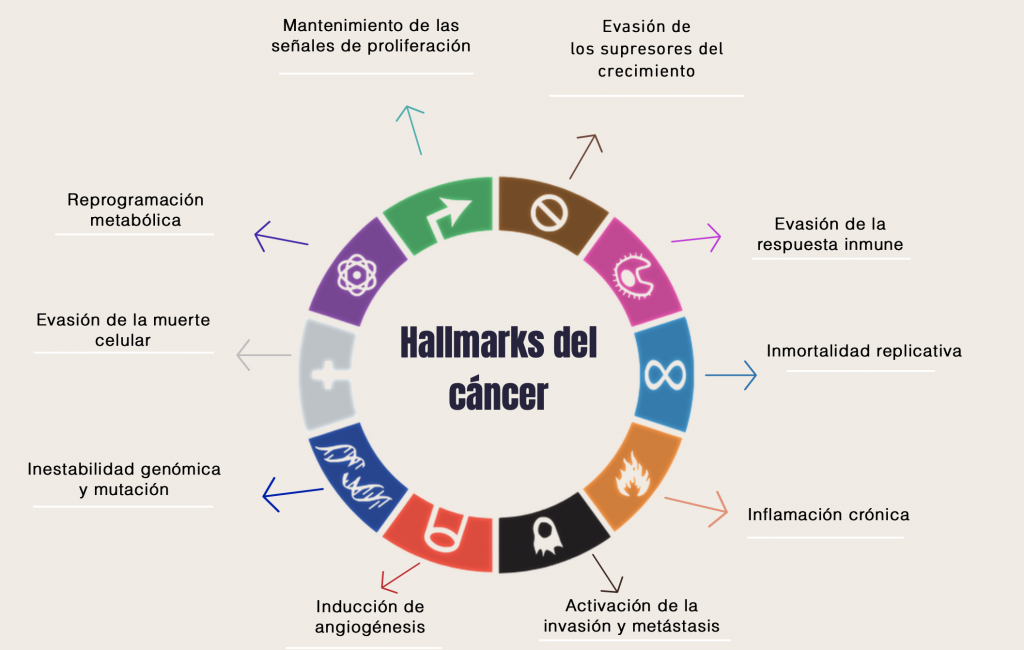
El cáncer es una patología compleja que abarca más de 200 tipos de enfermedades con diferentes subtipos, evoluciones, tratamientos, diagnósticos y pronósticos. Sin embargo, todos los tipos de cáncer mantienen una serie de mecanismos comunes que fueron recogidos y publicados en la revista CELL por Hanahan y Weingberg en su trabajo de revisión “The Hallmarks of Cancer” del año 2000 y, posteriormente, ampliado en 2011. Dichos autores emplearon el término hallmark que viene del inglés y se traduce como “una marca distintiva”. En total se han identificado 10 hallmarks del cáncer que se describen a continuación.
Índice de contenido:
Mantenimiento de las señales de proliferación
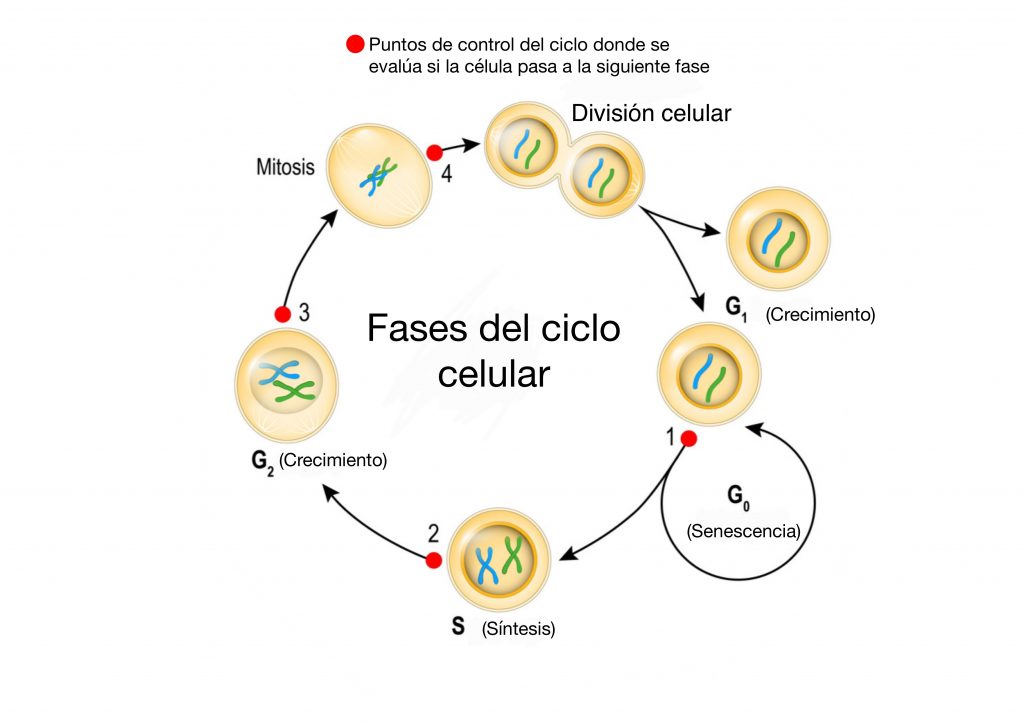
El ciclo celular es una secuencia ordenada de eventos que conducen a la proliferación y la división celular (mitosis), en la que una célula da lugar a dos células hijas. En la mayoría de los tejidos de los adultos, las células cesan la proliferación o se dividen ocasionalmente para reemplazar células perdidas en condiciones de daño o muerte celular.
Normalmente, en los tejidos sanos hay un control en la producción y la liberación de las señales que promueven la división celular, asegurando así un número adecuado de células y el mantenimiento de la arquitectura y la función de los tejidos. Sin embargo, la desregulación del ciclo celular conlleva a la aparición de diversas enfermedades, así como a la transformación neoplásica de los tumores que dan lugar al cáncer. El punto de partida del cáncer es la aparición de células en una región concreta del organismo donde comienzan a proliferar fuera de control. A pesar de existir distintos tipos de cáncer, todos ellos se originan a partir del crecimiento descontrolado de células alteradas, debido al mantenimiento de las señales de proliferación.
Ciclo celular, oncogenes y protooncogenes
¿Has oído hablar de los protooncogenes y los oncogenes? Se conoce que la transformación progresiva de células normales a células tumorales tiene como origen una cadena acumulativa de fallos o alteraciones en los mecanismos de regulación del propio organismo. Por tanto, en las células que dan lugar al cáncer hay un cúmulo de mutaciones (cambios) en aquellos genes que participan en la regulación del ciclo celular, los protooncogenes. Las mutaciones en los protooncogenes hacen que se convierta en oncogenes. Es decir, las células que comienzan a mutar se denominan protooncogenes; cuando se suceden una serie de mutaciones en los protooncogenes estos pasan a ser oncogenes, células tumorales. Finalmente, los oncogenes son los responsables de la transformación de una célula normal en una maligna que desarrollará un determinado tipo de cáncer. Como ejemplo, imagina que alguien pisa continuamente el acelerador de un automóvil, estimulando las células a dividirse. No existe un único tipo de oncogenes ya que por otro lado, existen oncogenes que funcionan como si se quitara el pie del freno estando estacionado en una colina, haciendo también que la célula se divida.
Evasión de los supresores del crecimiento
En las células tumorales también existen mecanismos para escapar de las señales que bloquean la proliferación celular. Por tanto, en esta fase de transformación neoplásica también ocurren alteraciones en los denominados genes supresores de tumores. Se define un gen supresor tumoral como aquel con la capacidad de suprimir algunas de las características de las células cancerosas u oncogenes. Dichos genes evitan la multiplicación y el crecimiento descontrolado de las mismas. Cuando sucede una mutación que origina la pérdida de función de estos genes, se contribuye a la proliferación descontrolada y la progresión tumoral del cáncer. Los genes supresores de tumores tratan de contrarrestar los efectos de los oncogenes.
Evasión de la respuesta inmune
Desde hace más de 150 años se conoce que el sistema inmune y el cáncer están muy relacionados. En los últimos años el sistema inmune está cobrando cada vez más importancia, pues se conoce que tiene un papel esencial tanto en la formación del tumor, como en la erradicación del mismo.
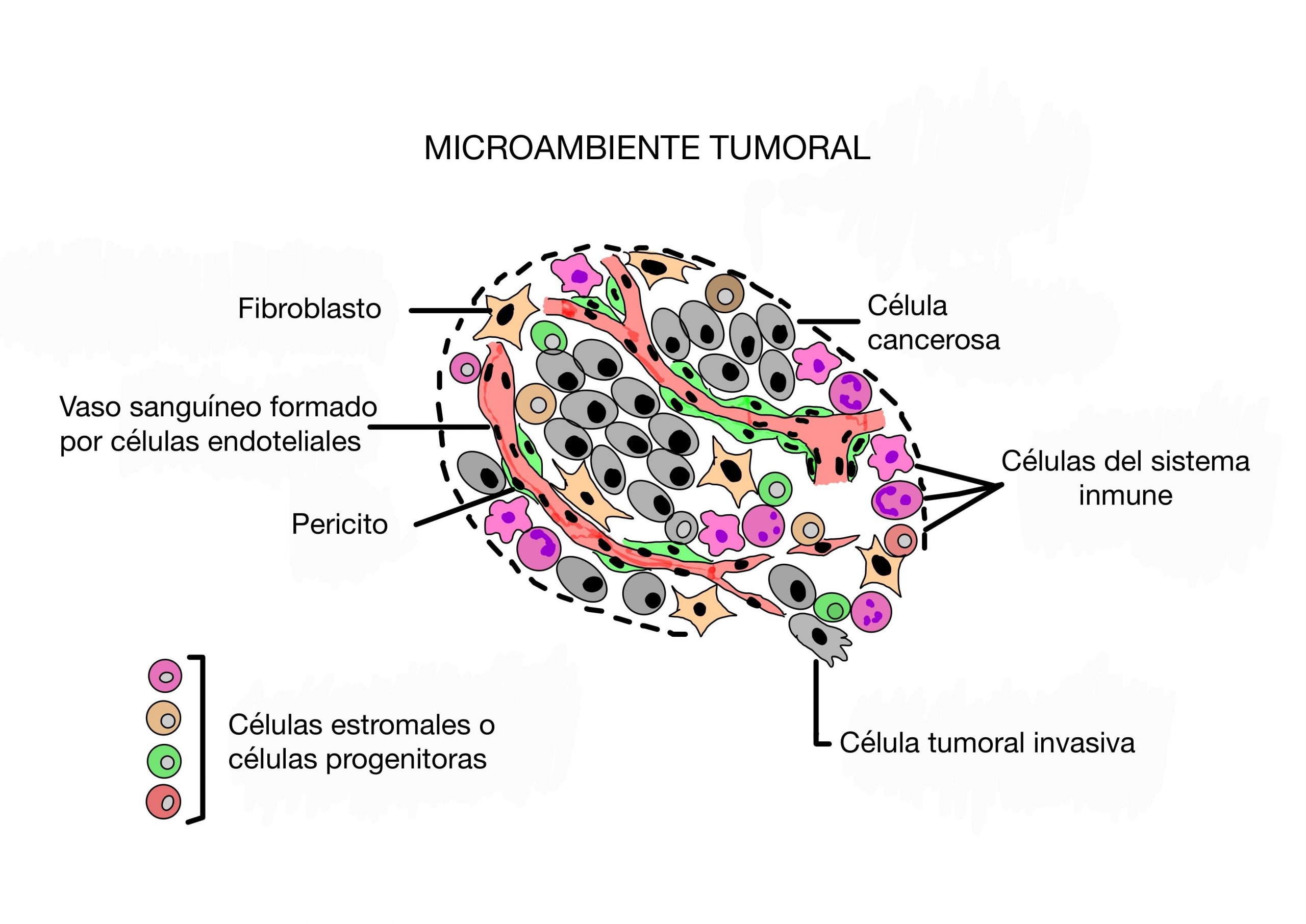
La evasión de la respuesta inmune en el cáncer puede desarrollarse en tres puntos: (i) las células tumorales; (ii) la composición y función de las células inmunes en la sangre periférica; y (iii) microambiente tumoral. Además de las células tumorales, el microambiente tumoral está formado por las células del sistema inmune (p. ej. las células T citotóxicas) y células que no forman parte del sistema inmune (p.ej. células endoteliales de los vasos sanguíneos o fibroblastos).
Así pues, el tumor tiene mecanismos extrínsecos e intrínsecos para evadir el control mediado por el sistema inmune. Los primeros son aquellos ajenos a las células tumorales, por influencia de las células no tumorales del microambiente sobre las células T del sistema inmune. Los segundos, son alteraciones que ocurren en las propias células tumorales a través de las cuales adquieren la capacidad de evadir el reconocimiento y/o la destrucción por parte del sistema inmune y emergen como tumores que crecen progresivamente.
El estudio del microambiente tumoral se ha revelado como un elemento de gran importancia a la hora de conocer la evolución clínica de muchos casos de pacientes con cáncer, como el melanoma, el cáncer de ovario o el colorrectal. Además, actualmente se están empleando y desarrollando de manera cada vez más eficiente las llamadas inmunoterapias que logran una respuesta clínica antitumoral significativa.
Inmortalidad replicativa
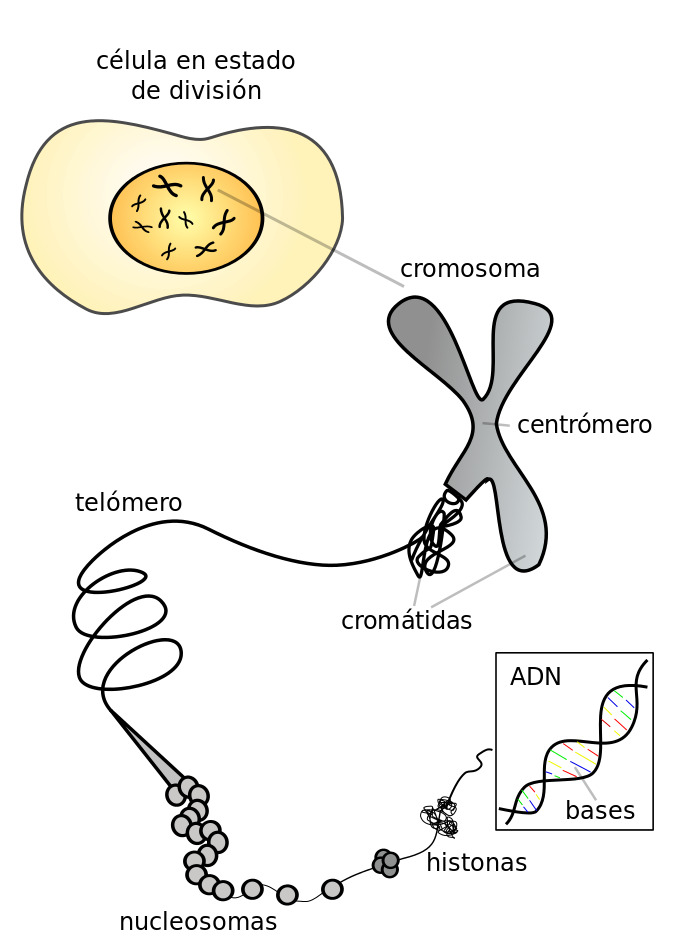
La mayoría de las células de nuestro cuerpo no pueden dividirse infinitamente, sino que tienen un número limitado de divisiones celulares. Uno de los motivos por los que las células dejan de dividirse es el acortamiento de los telómeros.
Los telómeros son unas secuencias de nucleótidos (las unidades moleculares básicas que forman el ADN) que se repiten y ocupan los extremos de los cromosomas, las estructuras macromoleculares en la que se empaqueta el ADN en todas las células. Dichos telómeros tienen la función de estabilizar a los cromosomas, evitando la inestabilidad genética y fusión de estos. Tras cada división celular, los telómeros se acortan poniendo en riesgo la integridad del material genético de la célula. Por lo tanto, el tamaño de los telómeros funciona como un reloj biológico, donde un mayor acortamiento de estos supone un menor número de divisiones. Una vez que llega al límite de divisiones, las células tienen dos caminos: la senescencia o la muerte celular. La senescencia celular es un estado con un metabolismo activo pero incapaz de llevar a cabo la división celular.
Solo algunas células del organismo, como los espermatozoides y los óvulos, pueden sobrepasar este límite y dividirse de manera indefinida al igual que las células tumorales en un proceso denominado inmortalización. Como habíamos adelantado antes, el crecimiento ilimitado de células precisa de la supresión de unos mecanismos. Para suprimir el reloj biológico que es el acortamiento de los telómeros, las células con alta capacidad proliferativa, como lo son el 90% de las células tumorales, mantienen activa una proteína denominada telomerasa. La telomerasa es la encargada de extender los telómeros y mantener la capacidad proliferativa de las células.
Puedes aprender más sobre los telómeros y la telomerasa en el siguiente artículo.
Inflamación crónica
La inflamación constituye una de las características comunes a todos los cánceres, mediante el suplemento de moléculas bioactivas por parte de las células del sistema inmune al microambiente del tumor. Desde hace años, los patólogos han observado que diversos tumores presentan infiltrados densos de células pertenecientes al sistema inmune y que, por tanto, permitirían que se dieran las condiciones inflamatorias que también surgen en tejidos no tumorigénicos. Cabe señalar que, casi el 20% de los cánceres humanos están relacionados con la inflamación crónica causada por infecciones, la exposición a agentes irritantes o por enfermedades autoinmunes. Dichos procesos inflamatorios pueden aumentar el riesgo de desarrollar cáncer y facilitan otros programas carcinogénicos, como por ejemplo la inestabilidad del genoma, la reprogramación metabólica y la evasión de la respuesta inmune.
Los mediadores de inflamación crónica contribuyen de forma inevitable tanto a la iniciación del tumor, como a su desarrollo y progresión a través de los oncogenes. Actualmente, multitud de investigaciones se centran en la identificación de bloqueantes farmacológicos para inhibir dichos procesos que inducen la inflamación.
Activación de la invasión y metástasis
La metástasis se define como la diseminación de células cancerosas a lugares secundarios distantes o cercanos, donde proliferan para formar una masa. Los tumores malignos se distinguen de los benignos por la ocupación progresiva y el reemplazamiento de los tejidos circundantes por células cancerosas (invasión).
Los procesos que promueven la metástasis dependen de complejos cambios bioquímicos y biológicos en las células tumorales y en el entorno. Para que ocurra la metástasis se necesitan numerosos pasos secuenciales y múltiples cambios genéticos. Es decir, del tumor original algunas células generan cambios en su genoma mediante mutaciones que les permiten invadir tejidos adyacentes y posteriormente sitios distantes (metástasis). Las células del tumor que adquieren las mutaciones adecuadas para la metástasis presentan cambios morfológicos, aumentan su motilidad y expresan enzimas específicas que degradan la matriz extracelular (entidad estructural que soporta y rodea las células en los tejidos). Además, algunas células del microambiente tumoral también favorecen estos procesos carcinogénicos.
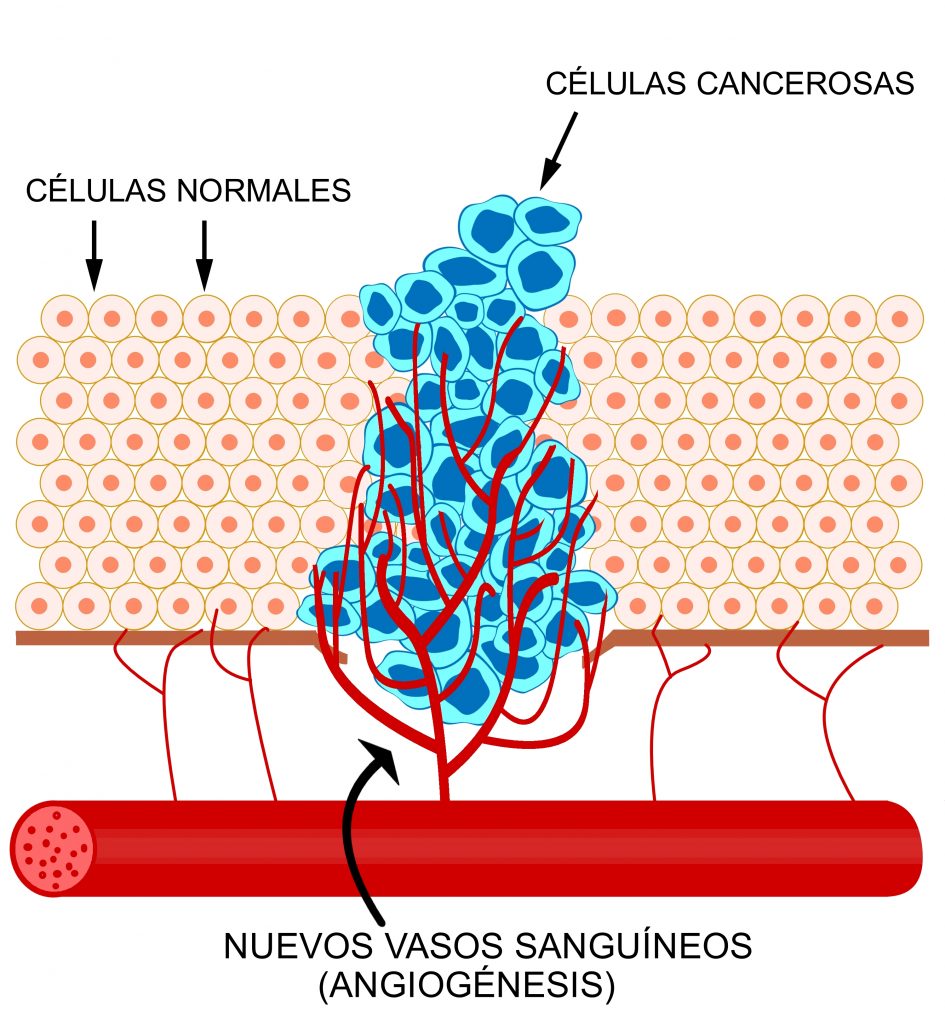
Inducción de la angiogénesis
Los vasos sanguíneos son necesarios para las células ya que aportan los nutrientes y el oxígeno que estas necesitan para su funcionamiento y desarrollo. La angiogénesis es el proceso de formación de nuevos vasos sanguíneos a partir de otros vasos preexistentes. Este proceso ocurre en el organismo de manera fisiológica, p. ej. en el desarrollo embrionario o en el proceso de curación de heridas. Por otro lado, la angiogénesis ocurre en determinadas patologías como el cáncer.
En el cáncer, la angiogénesis es fundamental para el crecimiento y el desarrollo del tumor, así como en la formación de metástasis. Los tumores no pueden crecer más de un determinado tamaño sin suministro sanguíneo, ya que las células que quedan encerradas en el interior del tumor comenzarían a quedarse sin el oxígeno y los nutrientes necesarios para su correcto funcionamiento. La falta de oxígeno o hipoxia que se genera dentro del tumor es el agente principal que causa el desequilibrio entre las señales activadoras e inhibidoras de la angiogénesis. Finalmente, se promueven las señales activadoras y se generan nuevos vasos sanguíneos en el tumor.
Inestabilidad genómica y mutación
Como se ha adelantado anteriormente, las células tumorales adquieren miles de mutaciones a lo largo de todo su genoma. En tumores avanzados el número de mutaciones puede estar en torno a las 100.000. La gran acumulación de mutaciones que se producen se deben a la inestabilidad genómica que implica todo el ADN de la célula. En los últimos años, se han identificado cerca de 30 genes que se mutan en una amplia gama de cánceres.
Para mantener una estabilidad genómica, las células en condiciones normales tienen una serie de mecanismos para reparar el daño que puede sufrir el ADN, además pueden detener el ciclo celular hasta que este daño haya sido reparado o inducir la muerte celular cuando el daño ya es muy extenso o irreversible. Por tanto, son los defectos o mutaciones en estos procesos los que promueven la inestabilidad genómica en las células cancerosas para adquirir propiedades ventajosas.
Evasión de la muerte celular
La apoptosis es una de las vías de muerte celular más estudiadas respecto a la aparición de tumores y constituyen uno de los principales puntos en los que actúan las células tumorales durante la progresión de un tumor. La apoptosis es un proceso que se induce a través de distintos estímulos, pero confluyen en vías moleculares comunes, culminando con la destrucción y degradación de las estructuras de la célula apoptótica, cuyos restos son “engullidos” por otras células del organismo.
En concreto, las células cancerosas poseen un amplio abanico de mecanismos de desregulación de la apoptosis en su beneficio. Entre ellos se encuentran la supresión de proteínas proapoptóticas, por lo tanto, se evita la apoptosis y las células normales pueden convertirse en malignas.
Reprogramación metabólica
Debido a la gran proliferación de una célula tumoral, necesita gestionar sus recursos energéticos de una manera distinta con respecto a las células normales. Dicha regulación se conoce como reprogramación metabólica. La reprogramación metabólica puede ser causada por mutaciones fijas que afectan al ADN, o bien por el ambiente tumoral.
Principalmente, esta reprogramación metabólica está enfocada en aumentar la cantidad de la principal molécula energética que tienen todas las células, el ATP. Gracias a ello, la célula está preparada para tolerar diversas situaciones estresantes para ellas, así como estar capacitada para sintetizar las estructuras esenciales para su supervivencia (macromoléculas como lípidos, ADN, ARN y proteínas).
Conclusión y perspectiva
El estudio de los hallmarks del cáncer ha permitido sintetizar la complejidad del cáncer en unos pocos principios y ha supuesto un punto de partida clave para enfocar las investigaciones sobre el pronóstico, diagnóstico y tratamiento de estas enfermedades.
Artículos que pueden interesarte
- La cura del cáncer: ¿Más difícil de lo que creemos? Terapia contra el cáncer
- La melanina ¿Amiga o enemiga?
- La acrilamida, un potencial carcinógeno en alimentos
- Páncreas a la carta: el futuro de la medicina regenerativa en el tratamiento de la diabetes
Referencias
Blog. Comprendiendo el cáncer. https://comprendiendoelcan.wixsite.com/cancer/los-hallmarks-del-cancer
Genome Gov. https://www.genome.gov/es/genetics-glossary/Oncogen
Cáncer Gov. https://www.cancer.gov/espanol/publicaciones/diccionario/def/protooncogen
Giraldo, N.A., Sanchez-Salas, R., Peske, J.D. et al. The clinical role of the TME in solid cancer. Br J Cancer 120, 45–53 (2019).
Hanahan, D., and Weinberg, R.A. (2000). The Hallmarks of Cancer. Cell 100, 57–70.
Hanahan, D., and Weinberg, R.A. (2011). Hallmarks of Cancer: The Next Generation. Cell 144, 646–674.
Sánchez, N. C. (2013). Conociendo y comprendiendo la célula cancerosa: Fisiopatología del cáncer. Revista Médica Clínica Las Condes, 24(4), 553-562.