El trastorno de depresión mayor (por sus siglas en inglés: MDD), o la llamada comúnmente depresión, es una enfermedad que se caracteriza porque las personas que la sufren presentan tristeza persistente, falta de interés o placer (anhedonia), fatiga, modificaciones importantes del peso corporal o pensamientos suicidas, entre otros síntomas.
Se estima que el 17% de los hombres y el 25% de las mujeres tendrán un episodio depresivo importante a lo largo de su vida, siendo bastante común la recurrencia en aquellas personas que ya han sufrido más de un episodio. En este sentido, la OMS clasifica la depresión como la tercera causa mayor de carga por enfermedad desde el 2008, y se estima que será la primera para el 2030.
Por todo lo anterior, se trata de una enfermedad muy grave a nivel mundial, y como tal la investigación sobre ella es cada vez mayor, habiéndose incrementado las publicaciones cada año en todo el mundo. Sin embargo, si esto es así, ¿por qué sigue siendo un problema tan patente y se estima que continúe creciendo? ¿Y qué es eso de que los antidepresivos son ineficaces? Para responder a estas preguntas, tendremos que conocer en mayor profundidad a esta enfermedad.
Índice de contenido:
Los inicios
La hipótesis monoaminérgica
En los inicios de la investigación de la MDD, se desarrolló la hipótesis monoaminérgica, que hoy en día es todavía la más conocida. Según esta hipótesis, la depresión se produce por una disminución de los niveles de monoaminas en el cerebro. Estas son moléculas que contienen un grupo amino unido a un anillo aromático y que pueden actuar, para lo que nos interesa, como neurotransmisores. Sería el caso de la noradrenalina, la serotonina y la dopamina (Fig. 1).
La disminución de los niveles de monoaminas se produce por una regulación a la alta de las monoaminas oxidasas, las enzimas responsables de degradarlas. Por un lado esto causa una disminución de los neurotransmisores en la hendidura sináptica, ya que son eliminados con demasiada rapidez. Por otro lado, se crea agua oxigenada como subproducto. Esta molécula causa estrés oxidativo en la neurona pero, de nuevo, en pacientes depresivos los sistemas antioxidantes no funcionan correctamente, produciendo daños que contribuyen a la patología de la depresión.
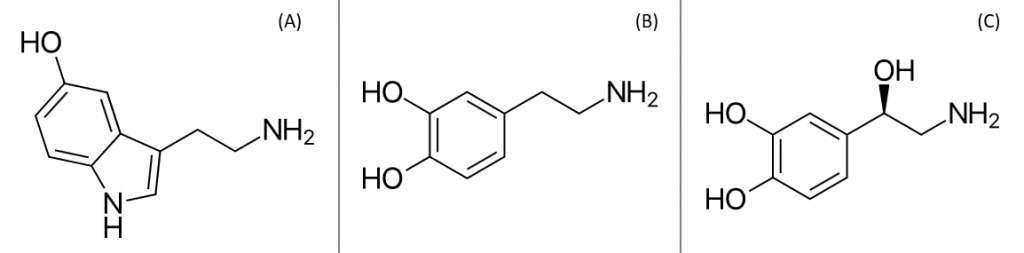
Extraídas respectivamente de https://commons.wikimedia.org/w/index.php?curid=752037, https://commons.wikimedia.org/w/index.php?curid=752089, https://commons.wikimedia.org/w/index.php?curid=46802614
Esta hipótesis surgió en los años 60, a partir del estudio del mecanismo de acción de los primeros antidepresivos. A partir de entonces, se crearon más antidepresivos en base a este supuesto, siendo todavía uno de los medicamentos más recetados para tratar la enfermedad. Sin embargo, existen una serie de aspectos que no se consiguen explicar desde la hipótesis monoaminérgica.
En primer lugar, aunque los medicamentos aumenten los niveles de monoaminas en el cerebro de forma muy rápida, los efectos terapéuticos no se dan hasta las 2 o 4 semanas después, o incluso más en algunos pacientes. Se ha propuesto que este tiempo de latencia se debe a una desensibilización o regulación negativa de los receptores de monoaminas. Sin embargo, actualmente se cree que el efecto antidepresivo es a través de la regulación de genes que promueven cambios en la neuroplasticidad cerebral, lo que explicaría por qué los efectos positivos solo se observan a largo plazo. Es decir, la latencia no ha podido explicarse desde la hipótesis monoaminérgica.
Por otro lado, según los datos obtenidos en el estudio STAR*D, solo un 30% de los pacientes consigue la remisión completa (desaparición de síntomas) con el tratamiento de un solo antidepresivo. De los que no responden, otro 30% conseguirá la remisión cambiando a un segundo antidepresivo. Sin embargo, las personas que continúan sin remitir, es decir, que siguen presentando algunos o todos los síntomas, tienen mucho peor pronóstico. Es más probable que su depresión no remita y que presenten recaídas en el caso de que sí. Esto es un alto porcentaje de pacientes que no responde adecuadamente a los antidepresivos convencionales, monoaminérgicos. Entonces, ¿qué está pasando?
Para responder a estas incógnitas, la comunidad científica se puso manos a la obra. Desde entonces, se han conseguido encontrar muchísimos procesos desregulados en las personas con depresión: la respuesta a estrés, el sistema inmune, la microbiota, etc. Por tanto, la hipótesis monoaminérgica ha quedado como una demasiado simplificada, y que tan solo explicaba uno de esos tantos mecanismos que están alterados. A continuación, nos adentraremos a conocer las principales vías de investigación que intentan entender la depresión, para así comprender por qué hay tanta variabilidad en los efectos terapéuticos de este tipo de antidepresivos.
Investigaciones actuales
Predisposición genética
Como muchas enfermedades, la MDD posee un componente genético. Los polimorfismos y variantes genéticas que se han encontrado asociadas a la depresión están implicadas en: la determinación de la estructura sináptica y la transmisión neural; el sistema serotoninérgico; la respuesta de estrés, etc. Sin embargo, la contribución de cada gen al fenotipo depresivo es muy pequeña. De hecho, se considera que el componente genético es relativamente bajo, oscilando entre un 31 y 42% (Pitsillou et al., 2020). (¿fuente?)
Por tanto, se puede decir que es el ambiente lo que principalmente contribuye al desarrollo de la MDD. De hecho, se ha observado una fuerte correlación entre el estrés y eventos adversos durante la niñez (componentes ambientales) con el desarrollo de depresión. Por ello, nuevas vías de investigación en epigenética están siendo estudiadas.
El eje hipotálamo-pituitaria-adrenal (HPA)
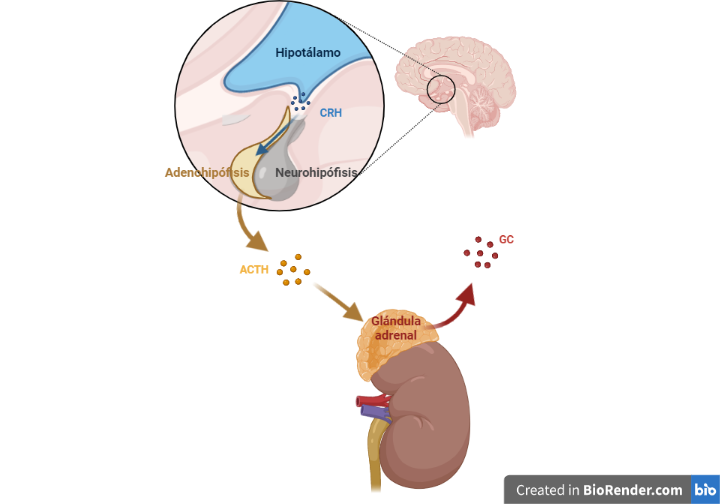
El eje HPA es una importantísima ruta de señalización neuroendocrina que regula un gran número de respuestas de nuestro organismo ante estímulos tales como la homeostasis del agua, la maduración sexual, el crecimiento o nuestro propio metabolismo, todo mediante la secreción de hormonas. Se trata de un proceso complejo, pero nosotros nos centraremos solo en una parte: la respuesta a estrés (Fig. 2).
El estrés es una respuesta comportamental y fisiológica que se produce para afrontar adecuadamente un peligro que se nos presenta. Gracias a él, en el pasado, podíamos huir de depredadores y, hoy en día, nos permite salir corriendo detrás del bus cuando llegamos tarde a un examen. En esta respuesta, ante un peligro físico o psicológico, nuestro hipotálamo da la orden, mediante la hormona liberadora de la corticotropina (CRH), a nuestra adenohipófisis o pituitaria anterior de que segregue hormona corticotropa (ACTH). Esta secreción viaja por nuestro torrente sanguíneo hasta la médula adrenal, sobre nuestros riñones, donde provoca la segregación de glucocorticoides (GC). Estas moléculas producen cambios en todo el organismo para hacer frente de forma exitosa al estímulo estresor.
Sin embargo, aunque prácticamente le debemos la vida a esta respuesta, no es siempre adaptativa. Cuando un estresor (fuente de estrés) se presenta de forma crónica o a largo plazo, los niveles de GC no vuelven a los niveles basales, provocando en el organismo un muy alto nivel de exigencia que puede llegar a causarnos enfermedades, entre ellas la MDD. Se ha encontrado una relación entre el estrés crónico, sobre todo estrés social (abandono, exclusión, etc.) y el desarrollo de MDD. De hecho, en el 40-60% de pacientes con MDD presenta anormalidades en el eje HPA.
Sin embargo, curiosamente, estas anormalidades parecen ser causadas en parte por el propio estrés. Cuando los niveles de GC se mantienen muy altos debido a estrés continuado, disminuye la presencia de sus receptores en el hipocampo, así como la afinidad de estos por los GC. El hipocampo es el encargado de regular el brazo negativo de la respuesta, es decir, es el encargado de apagarla cuando ya ha hecho su función. Por tanto, los altos niveles de GC están haciendo que el hipocampo no pueda percibir esos niveles.
En definitiva, se produce una espiral que estropea cada vez más la regulación negativa, por lo que los niveles de GC continúan aumentando. No solo eso, sino que además disminuye el volumen del hipocampo, algo también observado en pacientes con depresión. ¿Por qué?
Neurogénesis y plasticidad
Al descubrirse que el hipocampo de los pacientes con MDD tiene un volumen menor, surgieron dos hipótesis para explicarlo: la hipótesis de la neuroplasticidad y la hipótesis de la neurogénesis. La primera sostiene que esta disminución surge por cambios morfológicos en las neuronas (acortamiento de las dendritas, disminución del número de espinas dendríticas). Mientras tanto, la segunda explica que el menor volumen se debe a que se reduce la generación de nuevas neuronas en el hipocampo. Se han encontrado evidencias que apoyan ambas hipótesis, es decir, que el estrés afecta a la morfología y a la proliferación de las neuronas del hipocampo (Fig. 3).
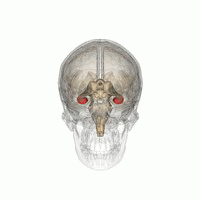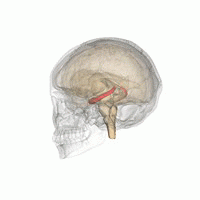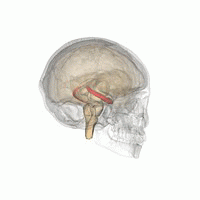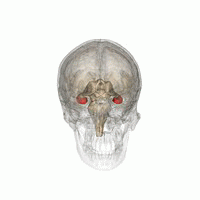
Dentro de la hipótesis de la neuroplasticidad, tiene gran importancia el factor neurotrófico BDNF. Los factores neurotróficos son glicoproteínas muy importantes en la supervivencia, crecimiento, diferenciación y plasticidad de las neuronas. Concretamente, el BDNF es el más expresado en nuestro cerebro. Esta molécula disminuye su expresión durante el estrés crónico, y se encuentra en niveles anormalmente bajos en personas con MDD. Por tanto, los cambios morfológicos pueden deberse en parte a esta anormalidad pero también a parte de los cambios en neurogénesis, ya que participa en la supervivencia y crecimiento celular de nuevas neuronas.
Glutamato y GABA
El glutamato (Fig. 4) es un aminoácido que funciona como el principal neurotransmisor excitador de nuestro cerebro. El sistema glutamatérgico está involucrado en procesos muy importantes como la plasticidad sináptica, cognición, recompensa y emociones.
Para que la función del glutamato sea la adecuada, sus niveles están extremadamente regulados por los astrocitos. Estas células son las encargadas de recaptar el glutamato en la hendidura sináptica, transformarlo en glutamina en su citosol y pasárselo de nuevo a las neuronas. Esta función es muy importante, ya que elevados niveles de glutamato producen una sobreexcitación en la neurona post-sináptica, causando toxicidad y alteraciones estructurales. Esta situación tan negativa generalmente se asocia con inflamación y estrés, y es lo que ocurre en los pacientes con MDD, ya que sus astrocitos están en menor número.

Por otro lado, GABA (Fig. 5) es el principal neurotransmisor inhibidor del cerebro. Este neurotransmisor está disminuido en pacientes con MDD. Es de gran relevancia, ya que aunque el número de neuronas gabaérgicas es mucho menor respecto a otro tipo de neuronas. Su función es esencial, pues regulan la actividad secretora de muchas otras neuronas.
Sistema endocanabinoide, endovanilloide y opioide
Estos tres sistemas cerebrales se encuentran alterados en la depresión. Se tratan de sistemas neuromoduladores pero, ¿qué significa esto? Los sistemas neuromoduladores son pequeños conjuntos de neuronas (en relación con el total de neuronas) que se localizan en unos pocos núcleos, pero cuyas proyecciones se extienden por todo el cerebro para modular la conectividad cerebral (Fig. 6). Integran señales de peligro, recompensa, novedad, esfuerzo, cooperatividad social, etc. y cuando interactúan con otras regiones del cerebro u otros sistemas dan lugar a funciones cognitivas superiores, tales como emociones, toma de decisiones, atención o comportamiento dirigido a un objetivo.
Los sistemas endocanabinoide y endovanilloide parecen jugar un papel central en la patología de la depresión, ya que afectan al nivel de neurotransmisores, a la neurogénesis y al eje HPA. Es de resaltar que se ha visto que, durante la depresión, algunos receptores del sistema endocanabinoide implicados en aumentar la expresión del BDNF están disminuidos. Esto produce una caída en los niveles de BDNF, influyendo fuertemente en neurogénesis y plasticidad.
Por otro lado, la desregulación del sistema opioide parece contribuir a que surjan alteraciones en el ánimo, interacciones sociales negativas y anhedonia social. Este trastorno se da porque este sistema se encuentra muy involucrado en la regulación del estado de ánimo. Las investigaciones actuales están analizando las diferencias funcionales entre los distintos subtipos de receptores opioides para evaluarlos como posibles dianas terapéuticas.
Inflamación
El papel de la inflamación en la patofisiología de la depresión se recoge en la hipótesis neuroinmune. Las primeras evidencias para ella fueron las elevadas tasas de depresión entre pacientes de enfermedades inflamatorias, autoinmunes e infecciosas. Un ejemplo es la artritis reumatoide, grave enfermedad autoinmune. También fueron de gran importancia los estudios que reportaron sintomatología depresiva al administrar citoquinas (CK), las principales moléculas proinflamatorias.
En pacientes depresivos se han encontrado defectos en la función inmune, sobre todo en las personas con elevada resistencia a antidepresivos. Ciertas CK están sobreexpresadas a nivel periférico, de forma que se vuelven capaces de atravesar la membrana hematoencefácilica por saturación y activar células del sistema inmune tanto periféricas como centrales. De entre estas células, nos centraremos en los astrocitos y la microglía, pertenecientes al sistema nervioso central.
Los astrocitos, como ya explicamos, regulan las concentraciones de glutamato, pero además están implicados en neuroprotección. Su activación por CK modifica su funcionamiento de forma que todos esos procesos se ven afectados negativamente. Por otro lado, la microglía de pacientes con MDD está desbalanceada. Esto significa que hay mucha más microglía de tipo inflamatorio (M1), que produce grandes cantidades de CK, que del tipo protector (M2). Además las propias CK producen por sí mismas retracción de dendritas y disminución de la neurogénesis hipocampal.
Esta hipótesis está fuertemente ligada con el eje HPA, ya que este eje regula también la respuesta inmune. Tan solo la exposición a estrés social en individuos sanos aumenta los niveles de inflamación, y a su vez la inflamación puede causar un estado de ánimo negativo. Por tanto, cuando los estresores ambientales se presentan de forma crónica y llega a dañarse el eje HPA, inevitablemente se desajusta la respuesta inmune, contribuyendo todo ello al desarrollo de la depresión. Sin embargo, esto no afecta a todos por igual. Ocurre principalmente en mujeres, debido a las características de sus hormonas sexuales.
Eje intestino-cerebro
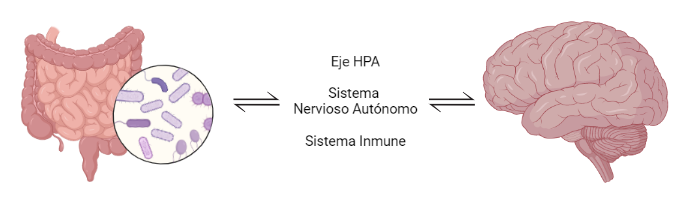
Este segundo eje del que hablamos se trata de una vía de interacción bidireccional entre el sistema nervioso de una persona y su microbiota intestinal (Fig. 9). Son muchas las evidencias que aseguran que este eje regula el estado de ánimo, el comportamiento y la transmisión neuronal de nuestros cerebros (Li et al., 2021). Los mecanismos todavía son bastante desconocidos, pero se cree que estos efectos se deben a la interacción que la microbiota puede tener con el eje HPA, el sistema nervioso autónomo y el neuroinmune (Fig. 7).
La primera evidencia de que esta vía de comunicación está relacionada con la depresión la encontramos en la elevada comorbilidad entre MDD y enfermedades gastrointestinales. Además, se han encontrado alteraciones en la microbiota de pacientes con depresión; y se ha observado que la microbiota afecta a los niveles de monoaminas, GABA y glutamato en el cerebro; y que cambios en la microbiota dañan la barrera intestinal produciendo altos niveles de inflamación por CK. Todo esto se relaciona con muchas de las causas que hemos visto anteriormente y, aunque es necesaria todavía una investigación más exhaustiva, no se puede negar que el eje intestino-cerebro tiene un papel importante en la patología de la depresión.
Conclusión
Para concluir, podemos decir que la depresión es un trastorno extremadamente complejo. Sus causas todavía no se comprenden por completo y estas parecen ser muchas y variadas, llegando a ser a nivel sistémico y no solo cerebral. Además, es un trastorno muy heterogéneo, es decir, no en todas las personas se presenta igual o los procesos están desregulados de la misma manera.
Por todo ello, todavía no se han podido diseñar antidepresivos adecuados que puedan suplir las necesidades de cada persona, haciendo que muchas tengan problemas con su medicación. A este problema se le suma que no existe una metodología para realizar prescripciones, ya que aún no existen biomarcadores fiables para determinar qué medicamento va a funcionar de forma óptima en cada persona. Por tanto, se trata de un sistema de prueba y error que puede alargar mucho el tiempo de intervención al paciente y su malestar.
Sin embargo, estos problemas han existido siempre solo que muchos no los conocíamos. La diferencia es que, ahora más que nunca, se está investigando la MDD. Se conoce en mayor profundidad y gracias a ello ya se están desarrollando nuevas intervenciones. Por ejemplo, recientemente la FDA ha aprobado la esketamina (Spravato), que afecta a los niveles de glutamato y de BDNF, entre otras consecuencias. Sus efectos terapéuticos son muy rápidos y será de ayuda principalmente a aquellas personas con depresión resistente a tratamientos. Por tanto, actualmente estamos más cerca que nunca de poder tratar la depresión de una forma mucho más fácil, rápida y personalizada.
Bibliografía
Avery, M. C., & Krichmar, J. L. (2017). Neuromodulatory systems and their interactions: A review of models, theories, and experiments. Frontiers in Neural Circuits, 11. https://www.frontiersin.org/articles/10.3389/fncir.2017.00108
Boku, S., Nakagawa, S., Toda, H., & Hishimoto, A. (2018). Neural basis of major depressive disorder: Beyond monoamine hypothesis: Neural basis of major depressive disorder. Psychiatry and Clinical Neurosciences, 72(1), 3-12. https://doi.org/10.1111/pcn.12604
Fila, M., Chojnacki, J., Pawlowska, E., Szczepanska, J., Chojnacki, C., & Blasiak, J. (2021). Kynurenine pathway of tryptophan metabolism in migraine and functional gastrointestinal disorders. International Journal of Molecular Sciences, 22(18), 10134. https://doi.org/10.3390/ijms221810134
Jelen, L. A., Stone, J. M., Young, A. H., & Mehta, M. A. (2022). The opioid system in depression. Neuroscience & Biobehavioral Reviews, 140, 104800. https://doi.org/10.1016/j.neubiorev.2022.104800
Le Merrer, J., Becker, J. A. J., Befort, K., & Kieffer, B. L. (2009). Reward processing by the opioid system in the brain. Physiological Reviews, 89(4), 1379-1412. https://doi.org/10.1152/physrev.00005.2009
Li, Z., Ruan, M., Chen, J., & Fang, Y. (2021). Major depressive disorder: Advances in neuroscience research and translational applications. Neuroscience Bulletin, 37(6), 863-880. https://doi.org/10.1007/s12264-021-00638-3
Lu, H.-C., & Mackie, K. (2016). An introduction to the endogenous cannabinoid system. Biological psychiatry, 79(7), 516-525. https://doi.org/10.1016/j.biopsych.2015.07.028
Lu, H.-C., & Mackie, K. (2021). Review of the endocannabinoid system. Biological Psychiatry: Cognitive Neuroscience and Neuroimaging, 6(6), 607-615. https://doi.org/10.1016/j.bpsc.2020.07.016
Mandelli, L., Petrelli, C., & Serretti, A. (2015). The role of specific early trauma in adult depression: A meta-analysis of published literature. Childhood trauma and adult depression. European Psychiatry, 30(6), 665-680. https://doi.org/10.1016/j.eurpsy.2015.04.007
Martín-Hernández, D., Ulecia-Morón, C., Bris, Á. G., Pereira, M. P., & Caso, J. R. (2021). Chapter 34—Monoaminergic system and antidepressants. En C. R. Martin, L.-A. Hunter, V. B. Patel, V. R. Preedy, & R. Rajendram (Eds.), The Neuroscience of Depression (pp. 345-355). Academic Press. https://doi.org/10.1016/B978-0-12-817933-8.00093-1
Niciu, M. J., Kelmendi, B., & Sanacora, G. (2012). Overview of Glutamatergic Neurotransmission in the Nervous System. Pharmacology, Biochemistry, and Behavior, 100(4), 656-664. https://doi.org/10.1016/j.pbb.2011.08.008
Pitsillou, E., Bresnehan, S. M., Kagarakis, E. A., Wijoyo, S. J., Liang, J., Hung, A., & Karagiannis, T. C. (2020). The cellular and molecular basis of major depressive disorder: Towards a unified model for understanding clinical depression. Molecular Biology Reports, 47(1), 753-770. https://doi.org/10.1007/s11033-019-05129-3
Rush, A. J., Warden, D., Wisniewski, S. R., Fava, M., Trivedi, M. H., Gaynes, B. N., & Nierenberg, A. A. (2009). STAR*D: revising conventional wisdom. CNS drugs, 23(8), 627–647. https://doi.org/10.2165/00023210-200923080-00001
Slavich, G. M., & Sacher, J. (2019). Stress, sex hormones, inflammation, and major depressive disorder: Extending Social Signal Transduction Theory of Depression to account for sex differences in mood disorders. Psychopharmacology, 236(10), 3063-3079. https://doi.org/10.1007/s00213-019-05326-9
Smaga, I., Bystrowska, B., Gawliński, D., Przegaliński, E., & Filip, M. (2014). The endocannabinoid/endovanilloid system and depression. Current Neuropharmacology, 12(5), 462-474. https://doi.org/10.2174/1570159X12666140923205412