Los medicamentos biológicos han transformado por completo la manera en que abordamos distintas enfermedades, ofreciendo soluciones efectivas ante problemas como el cáncer, enfermedades autoinmunes y trastornos hematológicos. Estos medicamentos son producidos a partir de sustancias biológicas, como proteínas, ácidos nucleicos, células vivas o tejidos y han mejorado la calidad de vida de millones de pacientes. Sin embargo, su complejidad estructural y proceso de fabricación es tan exigente que la investigación nos ha llevado a crear una nueva clase de fármacos: los medicamentos biosimilares.
Índice de contenido:
¿Qué es un medicamento biosimilar?
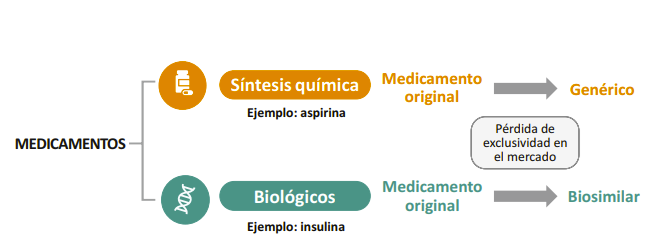
A pesar de la creencia común de que los medicamentos biosimilares son equivalentes a los genéricos, es fundamental destacar que no comparten la misma naturaleza.
Los medicamentos originales, también conocidos como productos de referencia, se producen generalmente mediante síntesis química, y establecen un estándar de seguridad y eficacia en la industria farmacéutica. Un ejemplo típico sería la aspirina.
Los medicamentos genéricos, en contraste, son copias exactas de los medicamentos originales. La facilidad de caracterización aumenta con moléculas más pequeñas, y su desarrollo se centra en demostrar la bioequivalencia, principalmente a través de estudios de farmacocinética. Todos hemos visto en las farmacias diferentes marcas de ácido acetilsalicílico, también llamado aspirina.
Los medicamentos biológicos, también llamados biológicos originales o de referencia, presentan estructuras moleculares grandes y complejas. Su fabricación, mediante biotecnología y tecnología de ADN recombinante, impone un control riguroso de calidad. Se someten a exhaustivos análisis de propiedades fisicoquímicas, actividad biológica, pureza, esterilidad y estabilidad antes de la comercialización para garantizar el cumplimiento de estándares.
Aunque los medicamentos biológicos tienen costos elevados, ofrecen una seguridad considerable al paciente, minimizando el riesgo de reacciones inmunitarias graves. Un ejemplo de esta categoría es la insulina.
Por otro lado, los medicamentos biosimilares, a pesar de compartir calidad, eficacia y seguridad con los biológicos originales, no son idénticos, son una copia similar debido a la complejidad de los procesos biotecnológicos utilizados en su producción. La variabilidad inherente en la fabricación de proteínas complejas y anticuerpos en células vivas introduce diferencias en la estructura y características de los productos. Aunque su desarrollo sigue estándares rigurosos y se someten a ensayos clínicos complejos para garantizar eficacia y seguridad antes de la autorización, las variabilidades en condiciones de cultivo y métodos de producción hacen que la replicación exacta sea desafiante. A pesar de estas diferencias con los medicamentos biológicos, los biosimilares desempeñan un papel crucial en la sostenibilidad del sistema sanitario al tener un precio más bajo que los biológicos originales, ofreciendo opciones terapéuticas más asequibles sin comprometer la calidad y la seguridad.
Los biosimilares ofrecen numerosos beneficios:
- Permitirían tratar a un mayor número de pacientes con el mismo presupuesto.
- Liberan recursos, los cuales se pueden usar para cubrir otras necesidades sanitarias.
- Aumentan la competencia de precios entre compañías, lo que se traduce en precios más bajos.
- Incentivan y aceleran la investigación de las compañías de medicamentos originales para el desarrollo de nuevas moléculas.
Aprobación de un medicamento biosimilar
Pese a que los biosimilares y los medicamentos biológicos comparten similitudes estructurales y en actividad biológica, las variabilidades en la producción biotecnológica pueden originar diferencias sutiles en la estructura, pudiéndose verse afectados los procesos que el medicamento desencadena en nuestro cuerpo. Por ello, los biosimilares se someten a rigurosos ensayos clínicos para demostrar su equivalencia en términos de calidad, eficacia, seguridad, farmacocinética, farmacodinamia e inmunogenicidad. Todos los medicamentos producidos mediante biotecnología deben obtener la autorización de la Agencia Europea de Medicamentos (EMA). Los requisitos de datos clínicos y preclínicos para la aprobación de un biosimilar difieren de los necesarios para autorizar un medicamento biológico con un nuevo principio activo, ya que, al demostrar la biosimilitud, el biosimilar hereda la experiencia acumulada en cuanto a seguridad y eficacia del medicamento de referencia.
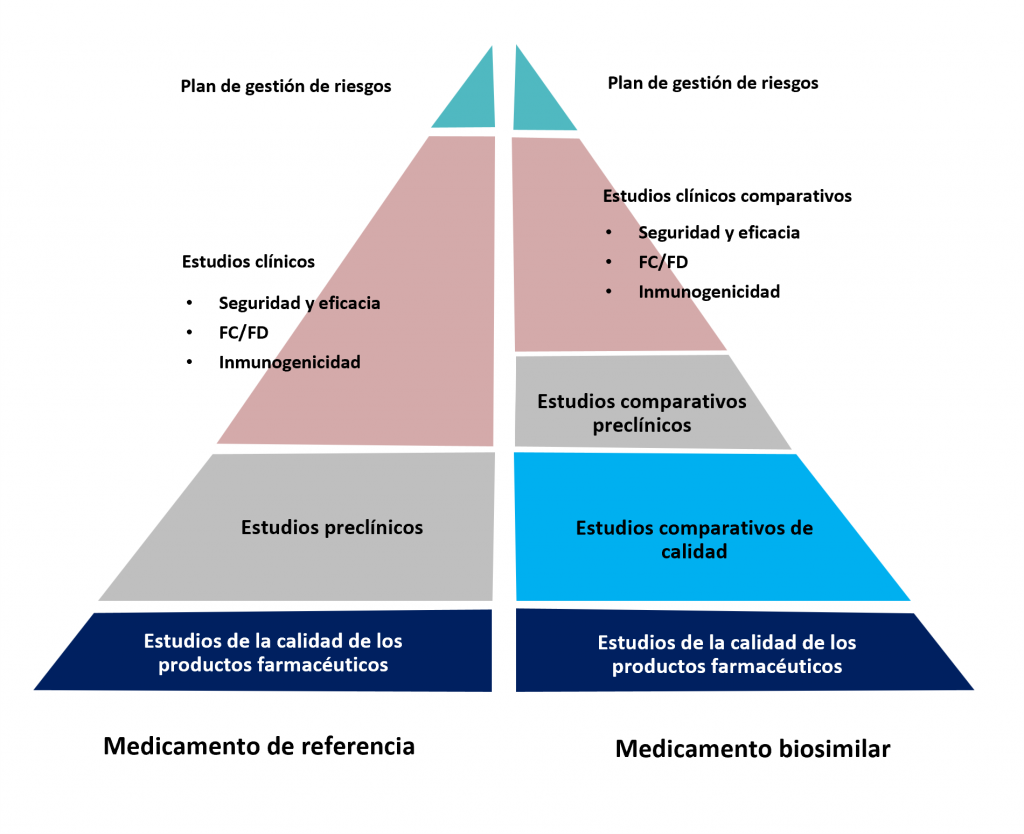
La seguridad se controla permanentemente por la EMA y por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Todos los medicamentos biosimilares, por su condición de medicamentos biológicos nuevos que salen al mercado, están obligados a incluir el triángulo negro, indicativo de que son medicamentos sujetos a una especial vigilancia de su seguridad.

Un medicamento permanecerá sujeto a seguimiento adicional durante 5 años o hasta que el Pharmacovigilance Risk Assessment Committee (PRAC) decida retirarlo de la lista.
Cabe destacar que en la UE, se han autorizado 74 medicamentos biosimilares, como por ejemplo la insulina glargina o el trastuzumab, y desde 2006 han beneficiado a 700 millones de pacientes.
Conclusiones
Los medicamentos biosimilares representan una evolución terapéutica significativa, ofreciendo opciones más asequibles y sostenibles sin comprometer calidad y seguridad. Su función fundamental en la sostenibilidad del sistema de salud los convierte en una innovación esencial, con beneficios tanto económicos como terapéuticos evidentes. Este avance resulta importante en el abordaje de diversas enfermedades, redefiniendo la atención médica y contribuyendo a una mayor equidad en el acceso de diferentes terapias.
Artículo editado por Silvia Moreno
Bibliografía
1. Guía de medicamentos biosimilares para farmacéuticos. BioSim-Asociación Española de biosimilares. Actualizado a enero de 2020.
2. Guía de medicamentos biosimilares para pacientes. BioSim-Asociación Española de biosimilares. Actualizado a enero de 2020.
3. Los biosimilares en la UE: Guía informativa para profesionales sanitarios. EMA y CE. Actualizado a octubre de 2019.
4. Libro en blanco de los medicamentos en España: Innovación y Sostenibilidad. Fundación Gaspar Casal, 2017.







