Estamos ya en 2023, y es raro encontrarse con alguien que no sepa de la existencia de las vacunas basadas en ARN mensajero. No en vano han revolucionado, de un modo totalmente modular y de rápida implementación, la vacunación frente a la COVID-19. Y es que la capacidad del ARN para codificar información es lo que ha hecho que estas vacunas sean tan fácilmente modulables y rápidas. Con saber una secuencia de proteínas, podemos enviar un plano a las células del sistema inmune para que aprenda a defenderse frente a nuevos patógenos.
Sin embargo, y como es habitual en ciencia, la emergencia de un campo de conocimiento viene acompañada de nuevos avances y oportunidades en los campos afines, ya que los laboratorios donde se desarrollaron estos avances comparten rasgos, equipos y técnicas de manipulación. Es exactamente lo que ha sucedido tras el éxito de las vacunas de ARN mensajero que permiten prevenir la enfermedad causada por el SARS-CoV2, agente causante de la COVID-19. La tecnología que permitía sintetizar y manipular las moléculas de ARN purificadas, y garantizar su estabilidad en el medio extracelular, ha permitido avanzar a otras líneas de investigación. Esto hace que vivamos un auge en el desarrollo de terapias y tecnologías ARN, con nuevos escenarios y estrategias de tratamiento.
Índice de contenido:
Pero… ¿qué es el ARN?
Empecemos por el principio. El ARN son las siglas de ácido ribonucleico, que es el nombre que damos a cadenas formadas por la combinación de unas moléculas llamadas nucleótidos, y cuyo orden de secuencia permite transmitir información. Mientras que el ADN (ácido desoxirribonucleico) se encuentra confinado en el núcleo, el ARN transcribe y traslada esta información fuera del núcleo, a los ribosomas (donde se sintetizan las proteínas), pudiendo también actuar en otras zonas de la célula donde realiza otras funciones, sobre todo, de regulación.
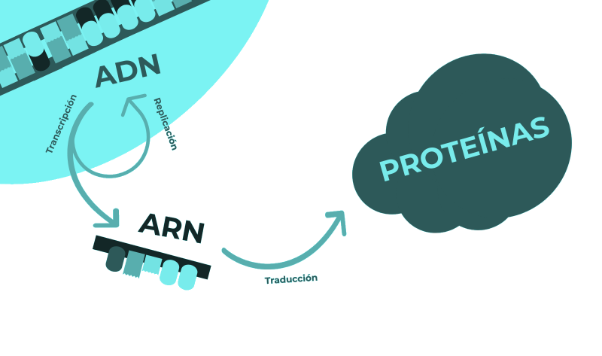
Fue Francis Crick, codescubridor de la estructura de doble hélice del ADN, quien en 1970 propone formalmente mediante un artículo en la revista Nature el dogma central de la Biología Molecular, describiendo un marco funcional donde el ADN se transcribe a ARN, y este, una vez fuera del núcleo se traduce a proteínas que son las que realizan las funciones celulares.
De hecho, durante mucho tiempo se pensó que estos ácidos nucleicos se limitaban a ser meros portadores lineales de información. Una visión que hoy sabemos algo limitada…
El ARN incluso tiene su propia teoría sobre el origen de la Vida, denominada el Mundo ARN, definiendo toda una potencial cadena de sucesos que podría haber generado los primeros organismos vivos, auspiciada por la particularidad de que el ARN, además, tiene capacidad autocatalítica.
Pero es al desplegar el potencial espacial del ADN y del ARN monocatenario, cuando accedemos a una nueva percepción de estas moléculas, que pueden plegarse de formas muy específicas y reproducibles en función de su secuencia, como si de un origami molecular se tratase. Así, se da lugar a estructuras secundarias y terciarias que les permiten reconocer y adherirse específicamente a ciertas moléculas «diana».
Y es en esta propiedad, en concreto del ARN, la que nos ocupa hoy para adentrarnos en la nueva terapéutica que está emergiendo en todas las etapas de los ensayos clínicos, definiendo una nueva etapa en la Medicina moderna.
La revolución de los aptámeros
Estas figuras de origami molecular formadas por cadenas sintéticas de ARN, y que por su secuencia son capaces de plegarse y unirse específicamente a, prácticamente, cualquier ‘diana’, es lo que denominamos aptámeros.
El término es una quimera lingüística que combina la palabra latina ‘aptus’, que significa ‘encajar’; y la expresión griega ‘meros’, que significa ‘parte’. Esto les permite unirse selectivamente a una gran variedad de moléculas, desde pequeños compuestos orgánicos, a receptores celulares.

Bien podríamos decir que los aptámeros son «anticuerpos químicos», ya que son bastante parecidos en lo que a especificidad y afinidad de unión se refiere, con la ventaja de que su síntesis depende de un proceso puramente químico.
Esto permite que todos los lotes de producción puedan ser perfectamente reproducibles, y que no sea necesario el uso de animales para su producción. Además, reduce los costes de síntesis y purificación, y se reducen las variaciones entre lotes, que son una característica inherente a la producción de anticuerpos con animales.
Son moléculas de pequeño tamaño y peso molecular, y por lo general, muy estables y que presentan una escasa toxicidad. Esta combinación de atributos los hace ideales para aplicaciones biomédicas, y ha generado que aquellas terapias que dependían exclusivamente del uso de anticuerpos, tengan nuevas alternativas y estén siendo reemplazadas, y cada vez más, por aptámeros.
¿Cómo se obtienen los aptámeros? El método SELEX para ARN
De momento, todo parece muy bonito, pero la realidad es que la generación de librerías funcionales de aptámeros no es algo trivial, e implica la selección de la secuencia o secuencias indicadas de tal modo que, para cada objetivo o procedimiento concreto, existe un tamaño o longitud, coordenadas de plegamiento, conformación espacial y capacidad de reconocimiento específicos, y cuyos atributos deben estar optimizados al máximo.
Si tomamos por caso que un aptámero puede tener entre 40 y 80 nucleótidos, donde el orden de secuencia es absolutamente imprescindible para obtener una función en concreto, nos damos cuenta de que el espectro de posibilidades en donde queremos identificar nuestro aptámero funcional, es del todo inabordable.
Y es que estaríamos hablando de seleccionar una, o unos pocos conjuntos de secuencias, de entre, por ejemplo, 1.18×1042 posibles combinaciones de 4 nucleótidos a lo largo de 70 posiciones (470). O lo que es lo mismo, un número seguido de cuarenta y dos ceros detrás.
Claramente, esto constituía una hazaña inabarcable, y lejos de cualquier experimento dirigido que pudiera aprovechar la potencia de esta tecnología.
Y así fue, hasta que en 1990 Tuerk y Gold desarrollan, como parte de su investigación, un nuevo método para seleccionar rápidamente secuencias de ácidos nucleicos que al plegarse pudieran unirse de forma selectiva a una «diana» específica, a partir de combinaciones de secuencias obtenidas por síntesis aleatoria. Llamaron a este método, SELEX, por sus siglas que en inglés se refiere a la evolución sistemática de ligandos por enriquecimiento exponencial (SELEX).
Como su nombre indica, el método SELEX (Figura 1) se sirve del principio de evolución de Darwin, empleando para ello sus motores principales: variación, selección y replicación (Figura 1).
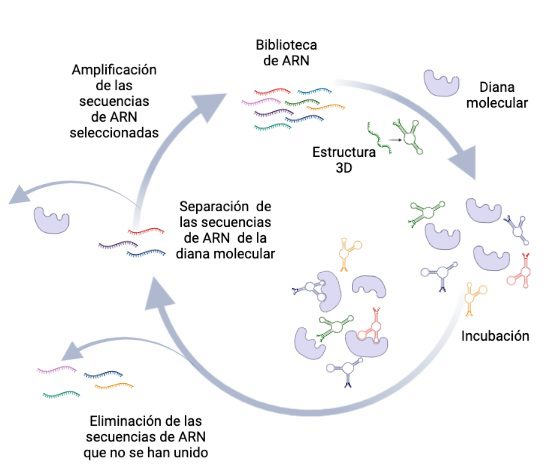
- Se establece una fuente de variación, sintetizando de forma más o menos aleatoria una población heterogénea de ARN en condiciones que permitan su plegamiento, que es lo que les va a permitir adquirir su capacidad de reconocimiento y unión y selectiva.
- Se incuba en presencia de la “diana” deseada, nuestra molécula de interés.
- Se descartan todas las combinaciones que no se han unido a la diana, y se mantienen en el ciclo aquellas que sí, seleccionando sólo las secuencias y combinaciones más exitosas.
- Se repite el proceso tantas veces como sea necesario.
Así, a partir de una biblioteca de ARN, compuesta por millones de secuencias diferentes, en cada ciclo mejoramos la afinidad de nuestros origamis de ARN por la “diana”, y enriquecemos nuestra mezcla en las secuencias que mejor se unen a nuestra molécula de interés, hasta que éstas, dominan completamente la población.
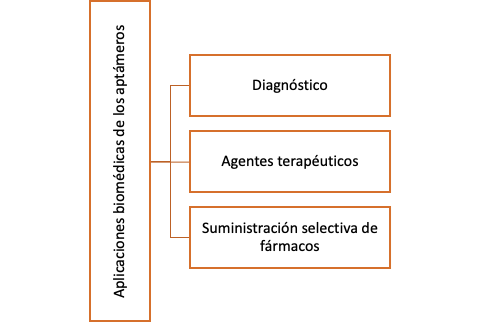
Aplicaciones biomédicas de los aptámeros de ARN
Actualmente hay multitud de campos de investigación, desarrollo, diagnóstico y tratamientos basados en los anticuerpos. Son moléculas con una estructura común que son capaces de unirse selectivamente a, virtualmente, cualquier molécula.
Como ya hemos visto, las propiedades de los aptámeros han hecho que supongan una tecnología susceptible de participar en multitud de estos campos con algunas ventajas notables.
Gracias a sus características y estructura química únicas, los aptámeros se ofrecen como
candidatos ideales para su uso en aplicaciones analíticas (biosensores, cromatografía) o incluso médicas.
Sin embargo, su principal limitación en este último campo, es su susceptibilidad a ser degradados por nucleasas (enzimas que rompen la columna vertebral del ARN o del ADN, y por tanto, la cadena y configuración espacial de los aptámeros). Esto, actualmente, limita su aplicación in vivo.
A pesar de ello, sus propiedades químicas hacen que su estabilidad se pueda modular, y así mejorar su grado de aplicabilidad. Además, algunas de sus ventajas hacen que sigan siendo una opción muy válida para otros campos de medicina, donde esta limitación no impide su correcto desempeño:
Diagnóstico
La clave para la prevención y el tratamiento de enfermedades, es un diagnóstico temprano y preciso. Con este fin, se suelen identificar y categorizar indicadores “diana” que permiten conocer el estado de un órgano, sistema o patología, así como la presencia de un patógeno, de un tóxico, o de un alérgeno.
Para ello, necesitamos de métodos que impliquen el uso de agentes de detección que posean: alta afinidad, y alta especificidad para la molécula «diana». Aquí, es donde participan los aptámeros.
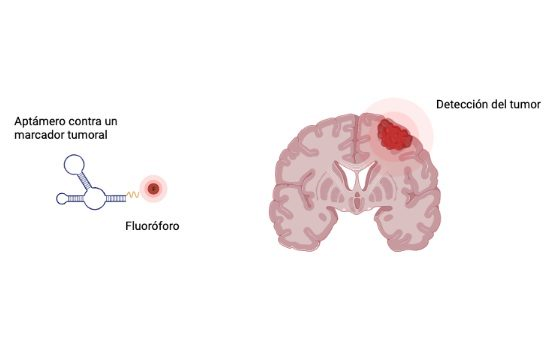
Además, debido a su pequeño tamaño, los aptámeros pueden penetrar eficazmente en las células y los tejidos, y gracias a su rápida difusión a través de la circulación sanguínea, tienen un tiempo de residencia muy bajo, siendo eliminados del organismo en poco tiempo. Esta propiedad los hace especialmente interesantes cuando se usan en combinación con agentes citotóxicos, como radiomarcadores terapéuticos, lo que facilita su eliminación del organismo de forma mucho más ágil.
Es solo un ejemplo de cómo los aptámeros pueden llegar a ser extremadamente útiles para guiar uno o varios agentes de contraste con la precisión suficiente como para dirigirse al tejido deseado (Figura 2). Esto les permite ser usados en sistemas tan conocidos como la resonancia magnética, o la tomografía computarizada. De hecho, los aptámeros ya han sido empleados, con éxito, para la detección y la obtención de imágenes de tejido cancerígeno metastático, así como de diversos tumores in vivo.
Agentes terapéuticos
Por su reducido tamaño, en comparación con otras moléculas y proteínas, los aptámeros tienen la propiedad de competir con multitud de moléculas pequeñas y ligandos de proteínas, inhibiendo así respuestas celulares y fisiológicas a nivel de los receptores «diana».
Esto hace que los aptámeros supongan una nueva potencial herramienta terapéutica muy prometedora, modulable y versátil.
En el caso del cáncer, una de las estrategias de tratamiento es modular los mecanismos de señalización intracelular. Las terapias para el cáncer basadas en aptámeros, generalmente implican la unión del mismo, directamente a un receptor molecular específico en la superficie de la célula. De este modo se impiden los cambios estructurales que la unión a ligando provoca en la molécula “diana” (el receptor), y se inhibe la señalización en cuestión, controlando las interacciones del tumor con su ambiente, dentro del tejido afectado. (Figura 3). Esta es, por ejemplo una forma de prevenir y controlar la multiplicación descontrolada de las células cancerosas, limitando el crecimiento del tumor.
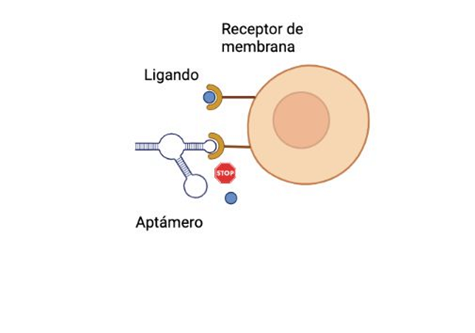
Suministro y liberación de fármacos mediante aptámeros de ARN
Más recientemente, en los últimos años, los aptámeros se han perfilado como una de las herramientas más prometedoras para la suministración específica de agentes terapéuticos, debido a su notable capacidad para ser rápidamente internalizados.
Desde el desarrollo del método SELEX para la obtención de aptámeros a la carta, han surgido métodos modificados para estandarizar la inclusión de nuevas propiedades en la producción selectiva de aptámeros. Algunas de estos métodos son:
- Cell-SELEX: para incluir en las propiedades de selección la compatibilidad con células vivas.
- Cell-internalization SELEX: para la selección de aptámeros con la capacidad ser internalizados rápidamente por las células, accediendo con alta eficiencia a dianas intracelulares, una vez han sido traslocados al interior celular.
De esta forma se ha logrado que, además de poder producir aptámeros con la capacidad de diferenciar entre células sanas y tumorigénicas, éstos sean capaces de penetrar en las células del tumor. Por este mecanismo, mediante el reconocimiento de ciertos biomarcadores o receptores de membrana, los aptámeros son capaces de actuar como vehículos para el suministro del agente terapéutico únicamente en las células y los tejidos donde son realmente necesarios. Esto, reduce o evita la toxicidad y los efectos secundarios que están asociados a la distribución inespecífica en el cuerpo, y optimiza la dosis suministrada y la cantidad de fármaco que puede alcanzar potencialmente su diana terapéutica.
Estos sistemas de administración de fármacos, basados en el uso de aptámeros, se pueden clasificar en tres categorías principales (Figura 4):
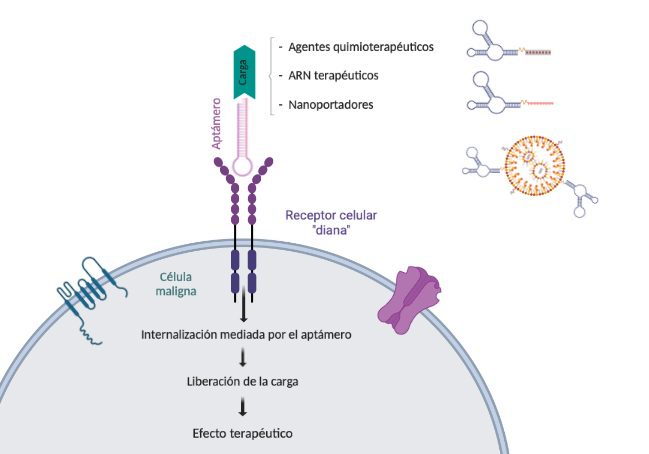
- Sistemas conjugados de aptámero-fármaco: siendo los más frecuentes agentes quimioterapéuticos. Como la Doxorrubicina, que induce la muerte de las células cancerosas, intercalándose en su ADN.
- Sistemas conjugados de aptámero-ARN: consistentes en otros tipos de ARN que pueden modular la expresión de genes asociados a la enfermedad. Entre ellos destacan los siRNAs, miRNAs, antimiRs y shRNAs. La ventaja de usar aptámeros para este sistema radica en su relativa facilidad de síntesis, pudiendo unirse directamente a uno de los extremos del aptámero de ARN.
- Sistemas conjugados de aptámero-nanomaterial. Aquí podemos incluir los liposomas, las nanopartículas de oro (AuNP), los nanotubos de carbono, etc. Los nanomateriales funcionalizados con aptámeros, son vehículos atractivos para aumentar tanto la vida media, como la carga útil del fármaco.
Conclusión
Nuestra comprensión de los tipos y funciones del ARN ha aumentado dramáticamente en los últimos 50 años, por no hablar de la profundidad con la que actualmente manipulamos, estudiamos y analizamos el ADN. Gracias a estos conocimientos y a las tecnologías a las que han dado lugar, se han desarrollado nuevas terapias y perspectivas biomédicas.
Estos avances, proporcionan diversas vías para explotar el ARN como un agente terapéutico. Y es de este modo que nacen los aptámeros. Al igual que los anticuerpos, los aptámeros tienen aplicaciones potenciales prometedoras en el diagnóstico clínico y a nivel terapéutico. Sin embargo, las investigaciones clínicas sobre aptámeros están en sus inicios y aún se necesita una comprensión más profunda de las interacciones aptámero-«diana» y la farmaco-cinética, para su posterior uso clínico.
Hasta el momento, sólo un aptámero ha sido aprobado por la FDA (Administración de Alimentos y Medicamentos de Estados Unidos) para uso clínico, comercializado bajo el nombre de Macugen en 2014, para el tratamiento de la degeneración macular.
No obstante, aún estamos lejos de dimensionar y aplicar el gran potencial de los aptámeros, máxime con la gran variedad de aptámeros que han sido desarrollados (muchos de ellos ya en fase de ensayos clínicos), y la cantidad de empresas que han sido creadas únicamente para explotar esta nueva tecnología.
Se estima que el mercado global de los aptámeros crecerá a una tasa de crecimiento anual compuesta (CAGR) del 21% entre el 2023 y el 2032. Actualmente, este mercado está dominado por Estados Unidos, seguido de Europa, donde España se ha postulado como claro jugador con tres empresas ya dedicadas al desarrollo de nuevas terapias basadas en aptámeros: Aptus Biotech, AptaTargets y Aptadel.
Y es que, aunque mucho menos conocidos que otros agentes terapéuticos basados en moléculas de ARN, es ya un hecho constatable que los aptámeros presentan un futuro muy prometedor. A medida que las investigaciones en este campo avanzan para proporcionar soluciones a las principales limitaciones asociadas a este tipo de moléculas (como pueden ser su bio-distribución cuando son administrados a personas, o su estabilidad), parece inevitable y clínicamente relevante que a medida que el campo crezca y los esfuerzos por desarrollar esta tecnología se perpetúen en el tiempo, veremos cada vez más ejemplos de estas moléculas que entren en ensayos clínicos, haciendo nuestra Medicina y nuestras vidas, un poco mejores y más seguras.
Editado por Diego Jiménez Lalana
Bibliografía
- CRICK, F. Central Dogma of Molecular Biology. Nature 227, 561–563 (1970). https://doi.org/10.1038/227561a0
- Stoltenburg R, Reinemann C, Strehlitz B. SELEX–a (r)evolutionary method to generate high-affinity nucleic acid ligands. Biomol Eng. 2007 Oct;24(4):381-403. doi: 10.1016/j.bioeng.2007.06.001.
- Morita Y, Leslie M, Kameyama H, Volk DE, Tanaka T. Aptamer Therapeutics in Cancer: Current and Future. Cancers (Basel). 2018 Mar 19;10(3):80. doi: 10.3390/cancers10030080.
- Fu Z, Xiang J. Aptamers, the Nucleic Acid Antibodies, in Cancer Therapy. Int J Mol Sci. 2020 Apr 17;21(8):2793. doi: 10.3390/ijms21082793.
- https://www.insightslice.com/aptamers-market
- https://myscientific.com/index.php/es/my-scientific-journal-esp/j1/aptameros-que-son-para-que-sirven
- https://oligofastx.com/es/aptamero/