El envejecimiento es un misterio intrigante que ha capturado la curiosidad de científicos y filósofos a lo largo de la historia y se presenta como uno de los fenómenos más complejos y fascinantes de la existencia humana.
A medida que avanzamos en nuestro conocimiento y comprensión de nuestro propio proceso de envejecimiento, surgen preguntas cada vez más profundas y desafiantes: ¿Cómo es que nuestro cuerpo, una maquinaria perfectamente diseñada, comienza a mostrar señales de deterioro con el paso del tiempo? ¿Por qué experimentamos arrugas en la piel, pérdida de elasticidad, disminución de la función cognitiva y otros cambios asociados con la edad? Estas preguntas fundamentales han llevado a la búsqueda constante de respuestas y teorías que nos ayuden a comprender el envejecimiento desde diferentes perspectivas.
Índice de contenido:
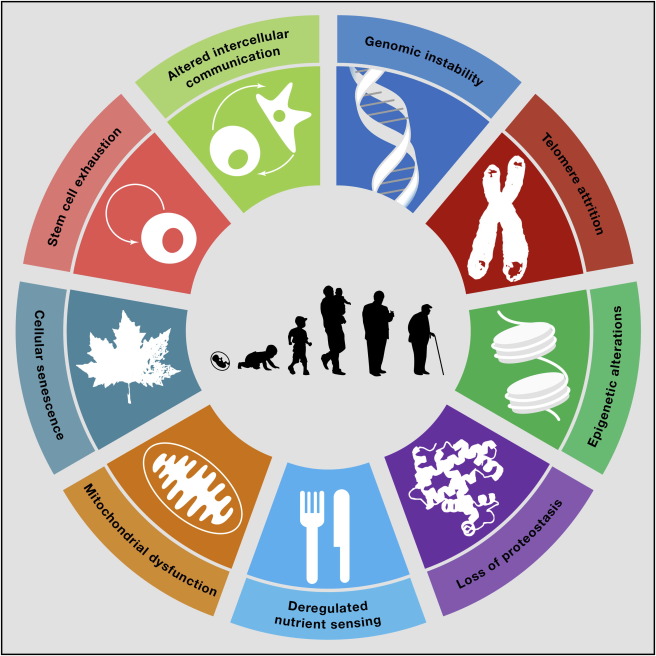
Las marcas distintivas del envejecimiento
En 2013, un grupo de investigadores publica un estudio en la revista Cell acerca de una teoría revolucionaria que arroja luz sobre el envejecimiento y ofrece una perspectiva fresca y prometedora. Según esta teoría, el envejecimiento y las enfermedades que conlleva son el resultado de las ‘marcas distintivas del envejecimiento’ o mejor conocidas como ‘The Hallmarks of Aging’:
- Inestabilidad del genoma provocada por el daño del ADN.
- Acortamiento de los telomeros (los extremos de los cromosomas).
- Alteraciones en el epigenoma.
- Perdida del buen mantenimiento de las proteínas o proteostasis.
- Fallos y cambios metabólicos.
- Disfunción mitocondrial.
- Acumulación de células senescentes que provocan inflamación crónica.
- Agotamiento de las células madres.
- Alteración en la comunicación intercelular y en la producción de moléculas inflamatorias.
Al explorar estas marcas distintivas del envejecimiento se ha abierto un nuevo panorama en la investigación científica. La comprensión de cómo estas características se entrelazan y contribuyen al proceso de envejecimiento ha llevado a la exploración de terapias y enfoques innovadores que podrían retrasar o incluso revertir algunos de los efectos del envejecimiento.
En la actualidad, hay pocas dudas de que esta lista de marcas distintivas, aunque tal vez pueda estar incompleta, nos proporciona indicadores precisos del proceso del envejecimiento y sus síntomas pero somos incapaces de explicarnos por qué dichas marcas aparecen en primer lugar.
La teoría del envejecimiento según David A. Sinclair
David A. Sinclair es profesor de genética en la facultad de Medicina de Harvard y una de las personas más influyentes según la revista Time. En los últimos años ha recibido más de 35 premios por su labor de investigación y sus grandes avances científicos que demuestran cómo podemos reducir la velocidad, o incluso revertir, el proceso del envejecimiento.
Según la teoría revolucionaria de Sinclair, detalladamente recopilada en el libro Lifespan, la razón por la cual las marcas distintivas del envejecimiento aparecen en primer lugar es por una pérdida de información. Seamos honestos, esto puede sonar poco revolucionario y lo es, si solo nos enfocamos en una pérdida de información de tipo genético.
Es importante destacar que en la actualidad sabemos que hay dos tipos de información en biología y que estas se encuentran codificadas de formas distintas. El primer tipo es la información digital o genética que se basa en un conjunto finito de valores posibles, en el caso del ADN es de base cuaternario, representado por los nucleótidos adenina (A), timina (T), guanina (G) y citosina (C). El otro tipo de información que posee nuestro cuerpo es la información analógica o epigenoma que comprende los rasgos que son hereditarios, pero que no se transmiten a través de los genes.
Para entender la teoría del envejecimiento por pérdida de información tenemos que rebobinar la película hasta el 15 Abril de 2003 cuando todos los medios de comunicación anunciaban la misma noticia: “El Human Genome Project logra secuenciar el mapa completo del genoma humano”. Maravilloso, aunque esto no era del todo verdad ya que habían enormes lagunas en la secuencia.
Las porciones faltantes del genoma, que a menudo consisten en repeticiones de nucleótidos, inicialmente se consideraron insignificantes y se clasificaron como ‘ADN no codificante’. Esta evaluación derivó en gran parte de los algoritmos originales diseñados para identificar genes, los cuales descartaban cualquier secuencia genética con menos de 300 pares de bases. Sin embargo, en contraposición a esta noción, se ha demostrado que existen genes que efectivamente codifican proteínas y que consisten en tan solo 21 pares de bases mínimo. Gracias a los recientes avances en la tecnología, en la actualidad sabemos que parte de este ‘ADN basura’ no solamente es de vital importancia, sino que se relaciona con el epigenoma.
Cuando David Sinclair postula que las características distintivas del envejecimiento surgen debido a una pérdida de información, su afirmación abarca tanto la información genética (digital) como la epigenética (analógica). Es en esta dualidad informativa donde radica la innovación de esta teoría.

¿Qué es el epigenoma y qué papel juega en el envejecimiento?
“Si el genoma fuera un ordenador, el epigenoma sería el software” , “Sin la información epigenética, los tejidos perderían rápidamente su identidad y dejarían de funcionar poco a poco, hasta fallar por completo.” afirma David A. Sinclair en su libro Lifespan.
Más en concreto esto significa que los factores epigenéticos actúan como un interruptor genético, es decir, regulan que genes están activos o inactivos en una célula determinada en un momento dado sin alterar en ningún momento la secuencia digital de ADN. Además quiere decir que, al producirse cambios o fallos epigenéticos, las células pierden su identidad desencadenando así la aparición de las marcas distintivas del envejecimiento y sus consecuencias.
Un ejemplo especialmente representativo se encuentra en los gemelos humano monocigóticos. En este caso, se estima que la contribución genética a la longevidad oscila entre un 15% y 20% mientras que el resto se encuentra bajo la influencia de los factores epigenéticos que pueden llevar a que dos individuos con idéntico ADN experimenten procesos de envejecimiento divergentes. Esta dinámica se vuelve perceptible al observar imágenes conjuntas de gemelos idénticos, en las que uno es fumador y el otro no. A pesar de que su ADN es mayoritariamente idéntico, el gemelo fumador exhibe ojeras más marcada, piel más reseca y arrugas más pronunciadas, evidenciando un envejecimiento acelerado en comparación con su contraparte no fumadora.
Circuito genético de supervivencia primordial: Gen A y B
Para entender los mecanismos epigenéticos, su función y como se han desarrollado el Doctor de Harvard hace referencia a un mecanismo que llama ‘Circuito genético de supervivencia primordial’. El circuito empieza hace millones de años con el Gen A, el cual se activa para evitar que las células se reproduzcan cuando las condiciones son duras y sigue con el Gen B, que codifica una proteína que silencia el Gen A cuando las condiciones son favorables. Además, con el paso de los años, el Gen A ha mutado para conseguir una segunda función: ayudar a reparar el ADN cuando este se rompe.
El propósito fundamental del circuito de supervivencia primordial radica en la instauración de un mecanismo intrínseco que orienta a nuestro organismo, en situaciones propicias, hacia la empresa reproductiva, en virtud de la ausencia de amenazas inminentes para nuestra supervivencia. No obstante, en condiciones desfavorables tales como la exposición al daño del ADN inducido por la radiación ultravioleta solar, este mecanismo ejerce su influencia moduladora sobre la tasa reproductiva, instando al organismo a restringir dicha actividad. En este contexto, se prioriza la imperativa tarea de reparar el material genético dañado, a fin de prevenir la emergencia de mutaciones durante los procesos de división celular subsiguientes.
A lo largo del tiempo este mecanismo de supervivencia ha ido evolucionando constantemente hasta nuestros días y estos genes han ido multiplicándose hasta formar una compleja red de vigilancia en nuestro cuerpo que constituye lo que llamamos epigenoma. Hoy en día la comunidad científica ha descubierto más de 24 genes relacionados con el mecanismo de supervivencia primordial y, por lo tanto, descendientes del Gen A y B. A estos genes se les conoce como Genes de la longevidad o Longevity genes.
Longevity Genes: las Sirtuinas, mTOR y AMPK
El foco de investigación de David Sinclair se centra en los genes de longevidad, específicamente en las Sirtuinas. En los mamíferos, existe una familia de siete Sirtuinas, conocidas como SIRT 1 hasta SIRT 7. Estas enzimas desacetilasas de histonas se originan principalmente del Gen B, por lo tanto su función principal radica en alterar la expresión genética, ya sea activando genes o silenciándolos según las demandas del organismo. Además de este papel esencial, las Sirtuinas también tienen un rol crucial en la reparación del ADN y esta doble función las convierte en elementos esenciales en la promoción de la longevidad y la salud celular.
Es fundamental resaltar que existen dos grupos adicionales de familias de genes que desempeñan un papel relevante en la regulación de la longevidad: mTOR (Mammalian Target of Rapamycin) y AMPK (Adenosine monophosphate activated protein kinase). Estos grupos contribuyen significativamente a la comprensión de los mecanismos subyacentes al envejecimiento y ofrecen objetivos potenciales para intervenciones anti-envejecimiento.
El grupo mTOR, conocido como objetivo de la rapamicina en mamíferos, es una vía de señalización celular crucial para la regulación del crecimiento y el metabolismo. Se ha observado que su actividad disminuye con la restricción calórica, promoviendo un proceso denominado ‘autofagia’ que se ha relacionado con la extensión de la vida en varios organismos. Por otro lado, la familia de genes AMPK, una quintasa activada por la adenosina monofosfato, se encuentra en una variedad de tejidos y participa en la regulación energética.
La activación de esta familia de genes, a menudo desencadenada por la restricción calórica y el ejercicio, ha demostrado efectos positivos en la prevención del envejecimiento. En conjunto, estos grupos de familias de genes, incluidas las Sirtuinas, mTOR y AMPK, construyen una red de regulación genética y metabólica que influye en el proceso del envejecimiento.
Validación experimental de la teoría de David Sinclair
Para respaldar su teoría sobre el envejecimiento debido a la pérdida de información, a lo largo de los años, David Sinclair llevó a cabo una serie de experimentos, uno de los cuales se publicó en 1997 en la prestigiosa revista Cell.
El experimento descrito en el estudio comenzó con la búsqueda del equivalente del gen WRN, conocido por ser la causa del síndrome de Werner en seres humanos, un trastorno hereditario que se caracteriza por un envejecimiento acelerado. Para llevar a cabo esta investigación, se focalizó en la levadura como organismo modelo.
Una vez confirmada la existencia de un gen homólogo en la levadura, se le asignó el nombre de Supresor de Crecimiento Lento 1 (SGS1) debido a sus siglas en inglés. Mediante un proceso de recombinación genética, se logró extraer el gen funcional SGS1 y se sustituyó por una versión mutada. Este paso se realizó con el propósito de verificar si la levadura podría ser inducida a manifestar síntomas similares al síndrome de Werner.
Cuando se llevó a cabo esta modificación genética, la esperanza de vida de las levaduras se vio drásticamente reducida a la mitad. No obstante, lo más significativo fue que las células no solo experimentaron un rápido deterioro, sino que su declive se acompañó de un evidente deterioro en su salud y su funcionamiento antes de su fallecimiento.
Luego de aplicar técnicas de tinción a las levaduras y llevar a cabo observaciones bajo el microscopio, los investigadores pudieron notar un fenómeno intrigante en las células SGS1 envejecidas. Específicamente, se observó que el nucleolo, que es la región donde se encuentra el ADN ribosómico (ADNr), había experimentado una especie de ruptura. Esto llevó al ADNr a iniciar procesos de recombinación y fragmentación, generando estructuras en espiral conocidas como ‘círculos extracromosómicos ribosómicos de ADN’ o ‘ERC’. Estos ERC se acumulaban progresivamente a medida que las células mutantes continuaban su proceso de envejecimiento.
Se procedió a realizar una comparación entre las células mutantes que se encontraban en proceso de envejecimiento y las células normales, pero de mayor edad, de levaduras. Este análisis reveló un hallazgo significativo: las células normales más antiguas también presentaban una acumulación de los círculos extracromosómicos ribosómicos de ADN (ERC). Este descubrimiento marcó la primera identificación de lo que hoy en día denominamos ‘ruido epigenético’.
Además, no solo el envejecimiento inducido provocaba la aparición de los círculos extracromosómicos ribosómicos de ADN (ERC), sino que, en respuesta al daño, la proteína SIRT2, previamente mencionada como descendiente del gen B, se desplazaba desde los genes relacionados con la reproducción y la fertilidad (que son descendientes del gen A) hacia el nucleolo.
Para las células de levadura, este cambio planteaba un problema, ya que SIRT2 es una proteína epigenética. Esto significa que, mediante su acción enzimática, se adhiere a los genes, envuelve el ADN y lo mantiene en silencio, asegurando que las modificaciones químicas conocidas como acetilaciones no se acumulen y descondensen el ADN. Cuando las Sirtuinas abandonaban los genes relacionados con la reproducción y la fertilidad (derivados del gen A), las células mutantes comenzaban a perder su identidad de manera similar a las células viejas, pero mucho antes en su ciclo de vida.
Cuando se publicó el estudio, Matt Kaeberlein, en ese entonces estudiante de doctorado, llevó a cabo un experimento adicional. Introdujo una copia adicional de SIRT2 en el genoma de las células de levadura para verificar si esto podría ralentizar el proceso de envejecimiento. Los resultados fueron afirmativos: la esperanza de vida de las células de levadura aumentó en un 30%.
¿Cómo podemos aplicar la teoría del envejecimiento de David Sinclair en nuestras vidas?
Otro descubrimiento significativo realizado por David Sinclair fue la observación de que las células de levadura, cuando se les proporcionaba una menor cantidad de azúcar en su alimentación, no solo vivían más tiempo, sino que además presentaban un ADN ribosómico excepcionalmente compacto. Esto tenía el efecto de retrasar de manera notable la acumulación inevitable de círculos extracromosómicos ribosómicos de ADN (ERC), roturas en el ADN, la ruptura del nucleolo, la esterilidad y, en última instancia, la muerte de las células.
¿Por qué sucedía esto? Someter las células de levadura a un ligero estrés se reveló como un activador clave del circuito de supervivencia, mejorando así la eficiencia de las Sirtuinas en su función de reparar el ADN. En la actualidad, las Sirtuinas a menudo se ven saturadas debido a diversos factores externos que provocan mutaciones en nuestro ADN, como la exposición a químicos y el consumo de tabaco, entre otros. Sin embargo, el verdadero desafío radica en restablecer la capacidad de las Sirtuinas para llevar a cabo su función de regulación epigenética de manera eficiente.
A lo largo de los años, se ha demostrado que la combinación de una dieta hipocalórica, ejercicio físico, exposición al frío y restricción en la ingesta de aminoácidos puede imitar los mecanismos de supervivencia y estimular los genes relacionados con la longevidad.
Este enfoque beneficioso para nuestro epigenoma opera de la siguiente manera: activa la enzima AMPK que aumenta la sensibilidad del organismo a la insulina, inhibe la vía mTOR, obligando a las células a gastar menos energía en el proceso de división celular y a gastar más en el proceso de autofagia y estimula los niveles de NAD (Nicotinamida adenina dinucleótido), lo que a su vez activa las Sirtuinas, actores fundamentales en la respuesta de emergencia ante el desgaste cotidiano que implica habitar el planeta Tierra.
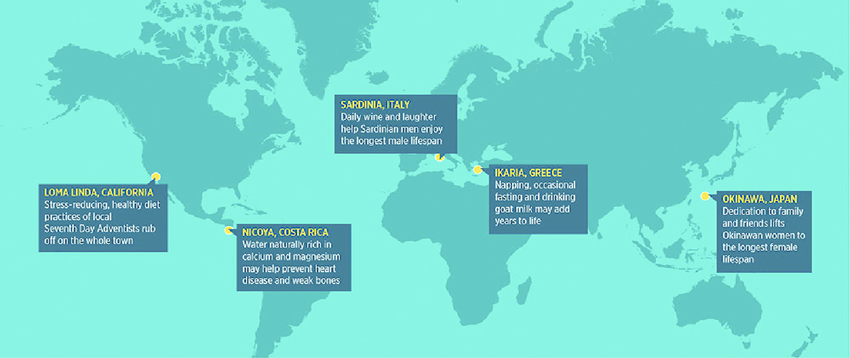
Estos genes de la longevidad han evolucionado para salvaguardar el cuerpo en tiempos de adversidad y su estimulación se traduce en beneficios para la salud y la longevidad. No sorprende que existan lugares en el mundo conocidos como ‘zonas azules’, donde la población practica estos métodos de promoción de la longevidad.
Un ejemplo notable es Icaria, una isla en Grecia que ha sido apodada «la isla donde a la gente se les olvida morir». En Icaria, aproximadamente un tercio de la población supera los noventa años de edad, y es interesante observar que la gran mayoría de los ancianos de la isla son seguidores de la Iglesia Ortodoxa, cuyo calendario litúrgico promueve el ayuno durante gran parte del año. Este enfoque en la restricción alimentaria como parte de su cultura religiosa podría estar contribuyendo a su longevidad.
Otro ejemplo de zonas azules se encuentra en Japón, donde la esperanza de vida es notablemente alta en comparación con otros países que no practican estos hábitos de vida saludables. Estos ejemplos demuestran cómo las prácticas de estilo de vida, como la restricción calórica y el ayuno intermitente, pueden tener un impacto significativo en la longevidad y la salud en diferentes partes del mundo.
En el ámbito científico, algunas de las moléculas conocidas que pueden imitar estos mecanismos de supervivencia y, por ende, activar los genes relacionados con la longevidad, incluyen la Rapamicina, la cual fuerza el organismo a ‘reciclar’ proteínas viejas y dañadas fomentando la autofagia, la Metformina, comúnmente utilizada para tratar el diabetes de tipo II, el Resveratrol, compuesto presente en pequeñas cantidades en el vino tinto y las moléculas precursoras de NAD, como NR (Nicotinamida ribósido) o NMN (Nicotinamida mononucleótida), compuestos involucrados en las reacciones químicas y en la producción de energía.
Estas sustancias ejemplifican cómo la investigación en este campo está avanzando hacia estrategias que pueden contribuir a mejorar nuestra salud y longevidad al activar los mecanismos de supervivencia naturales de nuestro organismo.
Es fundamental evidenciar que estas investigaciones se basan principalmente en experimentos realizados en modelos animales, con una aplicación limitada en estudios humanos debido a que este campo de investigación es relativamente nuevo. No obstante, se han observado y reportado beneficios en la salud humana sin efectos adversos significativos hasta la fecha.
Conclusión
El rompecabezas del envejecimiento revela que nuestra biología es una interconexión de información genética y señales epigenéticas, una coreografía compleja que dicta como envejecemos y como nuestras células responden a los desafíos del tiempo. Los genes de la longevidad emergen como piezas clave en esta danza genética, brindándonos posibles vías para influir en nuestro propio reloj biológico.
En conclusión, las investigaciones de David A. Sinclair ofrecen una valiosa perspectiva sobre cómo podemos mejorar nuestra salud y longevidad a través de la comprensión de los mecanismos fundamentales del envejecimiento. A medida que avanzamos, la ciencia no solo nos ofrece una visión más clara de los procesos internos de nuestro cuerpo, sino también la promesa de intervenciones que podrían ralentizar o incluso revertir los efectos del tiempo.
Artículo editado por Equipo de Microbacterium
Bibliografía
David A. Sinclair, Matthew D. LaPlante. (2021) Lifespan: Why we age and why we don’t have to.
Carlos Lopez-Otín, Maria A. Blasco, Linda Partridge, Manuel Serrano. (2013). The Hallmarks of Aging. Volume 153, Issue 6. Cell Press.
https://doi.org/10.1016/j.cell.2013.05.039
International Human Genome Sequencing Consortium. Finishing the euchromatic sequence of the human genome. Nature, 931–945 (2003).
https://doi.org/10.1038/nature03001
David A Sinclair, Leonard Guarente, Extrachromosomal rDNA Circles— A Cause of Aging in Yeast,
Cell, Volume 91, Issue 7,1997.
https://doi.org/10.1016/S0092-8674(00)80493-6
YANEZ-YANEZ, Rodrigo y MC ARDLE DRAGUICEVIC, Nelson. Zonas azules: longevidad poblacional, un anhelo de la sociedad. Rev. méd. Chile, 2021.
https://www.scielo.cl/scielo.php?script=sci_arttext&pid=S0034-98872021000100154
Kaeberlein M, Kirkland KT, Fields S, Kennedy BK. Sir2-independent life span extension by calorie restriction in yeast. PLoS Biol. 2004 September.
https://doi.org/10.1371/journal.pbio.0020296
Peter Belenky, Frances G. Racette, Katrina L. Bogan, Julie M. McClure, Jeffrey S. Smith. Nicotinamide Riboside Promotes Sir2 Silencing and Extends Lifespan via Nrk and Urh1/Pnp1/Meu1 Pathways to NAD+.







