Seguro que más de una vez has oído la famosa afirmación: «Somos lo que comemos». La ciencia siempre busca respuestas a interesantes preguntas. Por eso, este artículo intenta ligar dos disciplinas científicas aparentemente dispares, como son la epigenética y el metabolismo. Tras ello, intentaremos descubrir una pequeña base molecular que explicará porqué todo lo que comemos tiene un impacto en la expresión de nuestros genes. Por último, una breve conclusión te incitará a reflexionar sobre el efecto que tiene nuestra dieta en nuestra salud, sobre todo, física. Lo más importante que debes llevarte a casa es que todas las decisiones tomadas para saciar tu apetito tienen un impacto en las reacciones y procesos químicos que ocurren en tus células.
Índice de contenido:
Conceptos de epigenética y metabolismo
Comencemos por las definiciones de estos dos campos científicos en auge. La epigenética se define como la rama de la ciencia que estudia toda la regulación que se produce sobre la secuencia de ADN sin modificar las «letras» de la misma (A, T, G, C). Esta está vinculada con las modificaciones moleculares sobre estas «letras» sin cambiar la esencia de la base, es decir, el cómo es leída por nuestra maquinaria celular.
Algunas de las modificaciones a las que se hace más referencia y han sido más estudiadas son la metilación (o adición de grupos metilo: -CH3) de las citosinas del ADN y la adición de marcas moleculares (que actúan como «banderas de diferentes colores»). Estas últimas se hacen sobre las histonas, que son las proteínas que se encargan fundamentalmente de la estructura tridimensional del ADN. Estas modificaciones epigenéticas (Figura 1) serán clave para entender el resto del artículo y serán en las que nos enfocaremos.
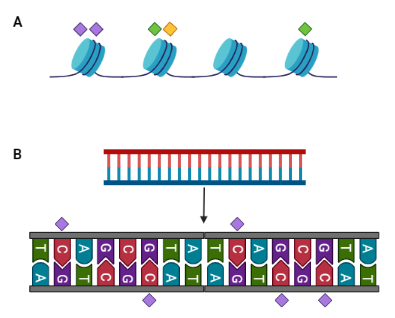
En cuanto al metabolismo, incluye todas aquellas reacciones químicas que permiten mantener en continuo funcionamiento a un organismo vivo a través de la producción de materia y energía. Nuestro metabolismo decide qué sustancias deben entrar en nuestro cuerpo para que puedan ser aprovechadas para obtener materia y/o energía, como azúcares, proteínas, grasas… Sin embargo, también regula la salida de aquellas que ya no son necesarias e, incluso, son tóxicas. Esto lo lleva a cabo a través de la orina (como la conocida urea), de las heces (todo lo que no se puede aprovechar, como la famosa fibra de los alimentos vegetales), la respiración (fundamentalmente dióxido de carbono o CO2), etc.
A todas estas moléculas que interaccionan entre sí en nuestro metabolismo se les conoce como metabolitos y a la aproximación científica que estudia sus múltiples interacciones, metabolómica. Como ahora podrás imaginar, conocer todos aquellos procesos químicos que ocurren en el metabolismo humano es un tema inabarcable y… ¡es uno de los múltiples propósitos de la ciencia!
Por tanto, nuestro complicado punto de partida será conectar la ingesta de alimentos, que acabarán convirtiéndose en metabolitos, con la modificación epigenética del ADN de nuestras células. Esta modificación se producirá debido a la utilización de estos metabolitos como marcas epigenéticas en el ADN o en las histonas.
Base molecular de la conexión epigenética-metabolismo
Ingesta, absorción y modificación de los alimentos
Normalmente, los alimentos contienen cuatro componentes macromoleculares que son degradados e incorporados como metabolitos: ácidos nucleicos (donde se incluye el ADN), proteínas, lípidos y glúcidos o azúcares. En algunas ocasiones, el cuerpo humano utiliza estos metabolitos para formar nuestros propios componentes macromoleculares, sobre todo en el caso de las proteínas y ácidos nucleicos. Mientras, en otras ocasiones, los utilizan para regular diferentes rutas del metabolismo humano. Para ello, seguiremos la ruta que sigue la glucosa, que es el azúcar más conocido y utilizado por nuestras células. Esto nos ayudará a comprender qué metabolitos pueden influir en la epigenética.
Cualquier azúcar que ingerimos debe ser convertido en glucosa o incorporado a la ruta de la glucólisis, que inicia la degradación de esa glucosa en el interior de la célula para aportar energía a la célula mediante un proceso conocido como respiración celular. Una serie de reacciones metabólicas originarán un metabolito muy importante denominado acetil-CoA. Por ello, el consumo de una gran cantidad de azúcares puede llevar a una alta producción de componentes de este ciclo.
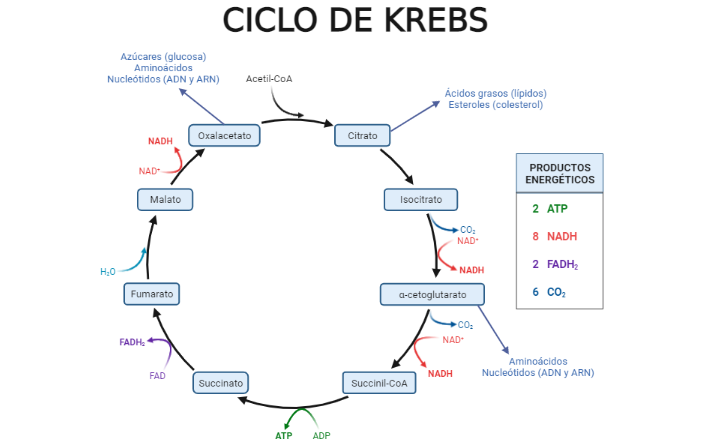
Este acetil-CoA puede entrar en el conocido ciclo de Krebs, una ruta metabólica que permite comúnmente la obtención de energía para las células (véase en Figura 2). Sin embargo, también puede salir al citoplasma de la célula para dar lugar a ácidos grasos. Estas dos opciones que se plantean permitirán marcar nuestros ADN e histonas.
Traducción de la ingesta en modificaciones epigenéticas
Para discutir la producción de marcas epigenéticas en nuestros genes, es importante conocer el concepto de expresión génica. La expresión génica es el proceso por el que se obtienen los productos que se originan a partir del ADN (ARN y proteínas). Por tanto, modificar la secuencia del ADN de partida puede tener un impacto en la cantidad obtenida de los productos en nuestras células.
La expresión génica se ve alterada cuando tanto el ADN como las histonas que lo acompañan sufren modificaciones. Algunas de esas modificaciones incluyen sobre todo la metilación de ADN, la metilación de histonas, que está asociada con una menor expresión del gen, y la acetilación de las histonas, asociada con una mayor expresión del gen.
Por tanto, una de las maneras de vincular el ciclo de Krebs con la epigenética sería poner el punto de mira en el acetil-CoA, el punto de inicio. Como bien indica su nombre, el acetil-CoA contiene un grupo acetilo que puede ser utilizado para que ciertas proteínas (enzimas) transfieran este grupo químico a las histonas unidas al ADN. Como curiosidad, algunos de los genes que son marcados cuando aumenta su cantidad en las neuronas del hipocampo (una región del cerebro) tienen que ver con la memoria, concretamente la memoria espacial a largo plazo. Por tanto, nuestra primera conexión es la memoria con la dieta.
Los otros dos componentes del ciclo de Krebs que parecen estar involucrados en el proceso de marcaje son el succinato y el fumarato. Se ha descubierto recientemente que estos impiden el funcionamiento de un tipo de proteína denominada desmetilasa que se encarga de eliminar los grupos metilo de las citosinas del ADN y de las histonas que lo acompañan. Concretamente, un subtipo particular de desmetilasas (JMJD o Jumonji C domain-containing proteins) parecen ser que juegan un papel clave tanto en cáncer como en infecciones.
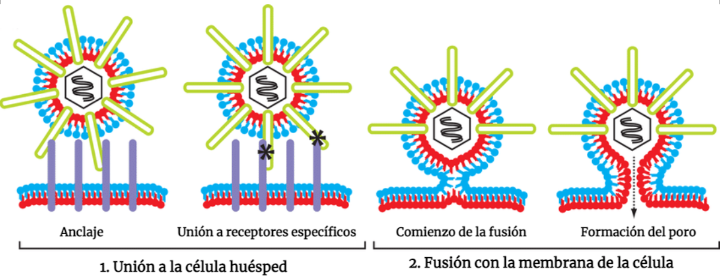
Por ejemplo, en 2012 se halló un compuesto antiviral que impedía que una desmetilasa de histonas (JMJD2) funcionara. Esto resultó ser efectivo contra el virus del herpes simple, al ser esencial para que la infección comenzase. Este virus es el causante de las «calenturas» o herpes labial que aparecen en nuestros labios y alrededores, y su infección es crónica. Por tanto, acabar con él, hasta el día de hoy, es todo un reto para la comunidad científica. Esta, por tanto, es nuestra segunda conexión: nuestra dieta con la aparición o el agravamiento de ciertas enfermedades.
La comunidad científica también tiene el foco puesto en una molécula conocida como itaconato, que proviene de la modificación de uno de los componentes del ciclo de Krebs. Este metabolito, además de participar en el cese de la inflamación, también tiene un rol epigenético participando en la disminución de los niveles de la vitamina B12 en la célula, una vitamina que está asociada con el desarrollo del sistema nervioso, la formación de glóbulos rojos, síntesis de ADN…
En última instancia y en lo que nos concierne, esta disminución de vitamina B12 provoca la acumulación de acetil-CoA (más acetilación) y la caída de otro metabolito (metilmalonil-CoA) que es aprovechado para el proceso de metilación. Además, se ha visto que el itaconato controla la gravedad de una enfermedad conocida como fibrosis pulmonar idiopática.
Este componente juega un papel muy relevante en el proceso inflamatorio y en la función de los macrófagos, que son las células del sistema inmune que se encargan de limpiar los alvéolos pulmonares tanto de patógenos como de suciedad. Por tanto, nuestra tercera conexión incluye a la vitamina B12 y al itaconato con la gravedad de la fibrosis pulmonar idiopática, una enfermedad crónica de la que se desconoce la causa.
Para ver una de las fascinantes funciones de los macrófagos, pincha en este enlace: «Macrophage engulfs foreign cells«, y observa cómo una célula de nuestro sistema inmune puede acabar con un patógeno en nuestro cuerpo.
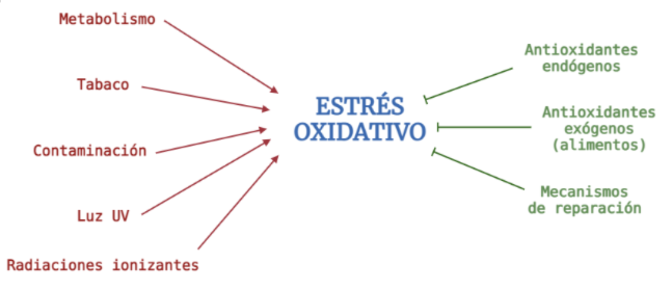
Por último, fuera del contexto del ciclo de Krebs, cabe destacar la existencia de los antioxidantes, que son moléculas que retrasan o previenen los daños en nuestras células. Son conocidos por estar presentes en grandes cantidades en la fruta y la verdura. Su importancia radica en su poder neutralizador de unos componentes conocidos como radicales libres que se producen en la célula debido a factores ambientales, como pueden ser el tabaco, el alcohol, la radiación…
Sabiendo que el cáncer surge de una anómala producción de células probablemente a partir de una célula que ha sido dañada, una gran ingesta de antioxidantes podría disminuir la probabilidad de sufrir algunos tipos de cáncer. Además, también se ha vinculado la progresión del envejecimiento con una alta cantidad de radicales libres. Sabiendo esto, estos componentes de importancia metabólica podrían retrasar la aparición de sus característicos rasgos. La última conexión incluye a nuestra dieta con el envejecimiento y el cáncer, que son a día de hoy una gran causa de preocupación.
Conclusión y nuevas aproximaciones
Como conclusión, podemos afirmar que sí que existe un fuerte vínculo entre la epigenética y el metabolismo y que, al menos en parte, sí que somos lo que comemos. Además, el itaconato resulta ser un metabolito del que se conoce muy poco y que podría estar implicado en otros tantos procesos, por lo que estudiar sus funciones podrían ayudar a entenderlo mejor. Aun así, es un campo muy amplio para dar conclusiones específicas y contundentes de cómo, por ejemplo, un alimento en concreto puede influir en nuestra capacidad de concentración o en la progresión de una enfermedad.
Por último, considerándolo ahora más necesario, debemos reflexionar sobre nuestra dieta y sobre cómo puede no solo contribuir en la epigenética, sino también en la progresión de ciertas enfermedades (cáncer, diabetes, cardiovasculares, neurodegenerativas como el Alzheimer…). De esta manera podremos disfrutar de lo que ponemos en nuestros platos a la vez que cuidamos de nuestra… ¡Salud!
¿Te apasiona la genética o la biología celular? Desde la escuela superior STEM Future Education te dan la oportunidad de formarte en estas disciplinas a través del Máster en Genética, Genómica y Biología Celular.
Bibliografía
1. What is Epigenetics? | Centers for Disease Control and Prevention. https://www.cdc.gov/genomics/disease/epigenetics.htm
2. Judge, A., & Dodd, M. S. (2020). Metabolism. Essays in biochemistry, 64(4), 607–647.
3. Mews, P., Donahue, G., Drake, A. M., Luczak, V., Abel, T., & Berger, S. L. (2017). Acetyl-CoA synthetase regulates histone acetylation and hippocampal memory. Nature, 546(7658), 381–386.
4. Rai, G. et al. (2012). Discovery of ML324, a JMJD2 demethylase inhibitor with demonstrated antiviral activity. In Probe Reports from the NIH Molecular Libraries Program. National Center for Biotechnology Information (US).
5. Cordes, T., & Metallo, C. M. (2021). Itaconate Alters Succinate and Coenzyme A Metabolism via Inhibition of Mitochondrial Complex II and Methylmalonyl-CoA Mutase. Metabolites, 11(2), 117.
6. Ogger, P. P. et al. (2020). Itaconate controls the severity of pulmonary fibrosis. Science immunology, 5(52), eabc1884.
7. Connolly, S. A., Jackson, J. O., Jardetzky, T. S., & Longnecker, R. (2011). Fusing structure and function: a structural view of the herpesvirus entry machinery. Nature reviews. Microbiology, 9(5), 369–381.
8. Hwang JY et al. (2017). The emerging field of epigenetics in neurodegeneration and neuroprotection. Nature reviews. Neuroscience, 18(6), 347–361.
9. Villanueva, L., Álvarez-Errico, D., & Esteller, M. (2020). The Contribution of Epigenetics to Cancer Immunotherapy. Trends in immunology, 41(8), 676–691.







