Dos pacientes son diagnosticados de hipercolesterolemia y se les prescribe a ambos atorvastatina 20 mg. Uno de ellos padece dolores musculares desde el inicio del tratamiento, aunque consigue una reducción en sus niveles de colesterol, mientras, el otro no sufre dolores pero no consigue reducir su hipercolesterolemia.
¿Por qué un mismo tratamiento varía en su acción y resultados en ambos individuos? ¿Qué determina estas variaciones? ¿Se puede predecir la acción, beneficiosa o adversa, de un fármaco en un paciente u otro? La farmacogenómica y la farmacogenética son capaces de resolver todas estas cuestiones y aportar una gran mejora al individualizar los tratamientos.
Índice de contenido:
El avance respecto al sistema ensayo-error
Tradicionalmente, se han definido dosis estándar o dosis tóxicas de cada tratamiento farmacológico, o se han indicado los medicamentos más o menos idóneos para un trastorno o síntoma en concreto, siempre de una forma general sin individualizar en cada caso. Como es lógico, a pesar de haberse definido estos estándares las respuestas a un determinado tratamiento son variadas entre individuos, tanto en cuanto a efectividad, como toxicidad o reacciones adversas.
Se ha usado el sistema de ensayo-error para comprobar el tratamiento más adecuado para cada persona y se han descubierto mediante este sistema multitud de reacciones adversas a fármacos a lo largo de los años. Tras recibir el paciente la medicación, se registra la reacción adversa y se identifica con el tratamiento en cuestión. Suena bien y de hecho el sistema funciona en la mayoría de los casos, pero como se puede intuir tiene sus limitaciones. Para superar estas limitaciones es posible recurrir a la farmacogenómica y la farmacogenética, en las que están puestas grandes perspectivas futuras.
Estas dos disciplinas tratan de definir los mecanismos genéticos por los cuales se producen variaciones en los tratamientos, teniendo como objetivo final implementar test genéticos para individualizar las terapias y predecir efectos adversos e ineficiencias.
Mediante análisis farmacogenómicos se han identificado ya numerosos genes y variantes relacionados con la acción de un fármaco concreto en el organismo. Una vez identificados los genes implicados en la respuesta a cada fármaco, se podrá realizar un análisis al paciente, previo al inicio del tratamiento, para comprobar si el paciente posee o no variantes de estos genes que puedan alterar la respuesta farmacológica. Se puede conseguir así prevenir reacciones adversas, ineficiencias del tratamiento o incluso efectos tóxicos. Si estos análisis se implementaran de una manera general se obtendrían grandes mejoras en numerosos tratamientos farmacológicos para gran cantidad de pacientes, individualizando las terapias al poder crearlas «a la carta» según las variantes genéticas y necesidades de cada individuo.
La mejora de los tratamientos farmacológicos
Las variantes genéticas pueden afectar a genes implicados en mecanismos de absorción, distribución, acción, metabolización o eliminación de fármacos. Cuando existe variabilidad en genes implicados en alguno de estos procesos entre distintos individuos, se produce la variabilidad en la respuesta a fármacos. Por tanto, un estudio farmacogenómico antes de recibir un tratamiento ayudaría a definir de qué forma actuaría el tratamiento en cada organismo.

Un buen ejemplo de la variabilidad de un mismo tratamiento entre individuos se produce en la metabolización de fármacos. En nuestro organismo, entorno al 90% de los fármacos son metabolizados por tan solo seis enzimas diferentes. ¿Qué quiere decir esto? Pues que una variante genética en el gen codificante de una de estas enzimas puede afectar a la metabolización de numerosos fármacos.
Según las variantes de estos genes presentes en cada persona se pueden definir metabolizadores lentos, intermedios, rápidos o ultrarrápidos. Lo que significa que un mismo fármaco puede mantenerse más tiempo activo en el organismo de un metabolizador lento, aumentando la posibilidad de aparición de efectos adversos, que en uno rápido o ultrarrápido, donde el fármaco permanece menos tiempo activo en el organismo, pudiendo producirse una reducción de su efecto. Es decir, la variante genética tiene consecuencias en los efectos farmacológicos, beneficiosos o perjudiciales, de un tratamiento.
El hecho de poder clasificar a los pacientes según el tipo de metabolizadores que son permite predecir efectos beneficiosos y adversos. Pero no solo en el caso de la metabolización la farmacogenómica y la farmacogenética son buenas herramientas.
Entrando en un ejemplo de fármaco en concreto, la farmacogenómica es muy aplicable en el caso de la simvastatina. Este principio activo es ampliamente usado en hipercolesterolemia. Su transporte entre el exterior y el interior de las células depende de proteínas transportadoras como es OATP1B1, transportador codificado por el gen SLCO1B1. Este transportador se encarga de la eliminación de la simvastatina de la circulación sistémica. Variantes que causan la disfunción de este gen provocan un aumento de la concentración sanguínea del fármaco. Este aumento lleva consigo un mayor riesgo de miopatía, principal efecto adverso del fármaco.
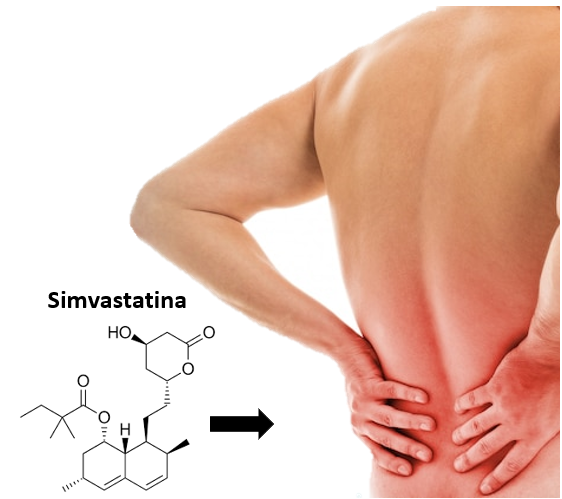
En este caso el análisis de este gen y la identificación de una variante ayudaría a prevenir este mayor riesgo de miopatías. La farmacogenómica evitaría así la técnica ensayo-error a la que se recurre actualmente. Es decir, cuando un paciente sufre de excesivos dolores musculares por el tratamiento con simvastatina se le cambia el principio activo a otra estatina de funcionamiento similar, pero no se busca la causa genética de estos dolores. Simplemente con el análisis farmacogenómico podrá conocerse la causa y adecuar el tratamiento y la dosis al paciente de una manera mucho más individualizada.
Si en este caso, por ejemplo, se identificara un gen como causante del efecto adverso, y se conoce que este gen no afecta a la respuesta farmacológica de la pitavastatina, otra estatina indicada para la hipercolesterolemia, se podría definir que para este paciente el tratamiento con pitavastatina es más recomendable que el tratamiento con simvastatina, sin necesidad de probar con ambos fármacos hasta dar con el correcto.
La farmacogenómica en el desarrollo de fármacos
De igual forma que la farmacogenómica se puede aplicar en la clínica, la aplicación en el desarrollo de fármacos sería muy beneficiosa. Estudiar los genes y las variantes conocidas que pueden afectar a la ruta farmacológica de un medicamento antes de comercializarlo ayuda a prevenir reacciones adversas y efectos de fármacos que quizás una vez comercializados los productos serían más difíciles de conocer. Este sistema ya se está aplicando y cada vez de manera más generalizada ya que cada vez hay más datos de variantes, genes y proteínas relacionados con fármacos y sus efectos.
Perspectivas futuras
Los estudios genómicos son aplicados en el diagnóstico y tratamiento de multitud de enfermedades, y también en la evaluación de determinados tratamientos. A pesar de ello, la aplicación de estos estudios a los tratamientos farmacológicos más comunes es todavía una tarea pendiente.
Aplicar la farmacogenómica de forma generalizada tiene amplias ventajas como ya se ha comentado. Además, el coste de estos estudios no supone un gran esfuerzo económico para el sistema de salud de un país, ya que realmente una muestra de sangre o saliva es, en muchos casos, suficiente para mejorar los tratamientos. Incluso, en la gran mayoría de tratamientos, se produciría un ahorro, ya que se pasaría de varias pruebas con varios tratamientos distintos hasta dar con el idóneo a imponer desde el inicio aquello que sabemos va a funcionar gracias a la farmacogenómica.
Bases de datos de farmacogenómica y farmacogenética en Europa y Estados Unidos, tales como PharmGKB o Consorcio de Implementación de la Farmacogenética en la Clínica (CPIC) (https://cpicpgx.org/), siguen avanzando y acumulando cada vez más información de fármacos, efectos, variantes y genes. Aún así, existen numerosas variantes por descubrir, o para las cuales la asociación con el efecto de un fármaco no se ha descrito o probado, y sobre las que se debe seguir investigando.
Por otra parte, el paso quizás más complicado de esta inserción de la farmacogenómica en el sistema actual, sería la creación de un modelo para que todo se realice de una forma segura y eficaz. La translación de los datos genómicos y genéticos a la clínica y al tratamiento de cada persona sigue siendo una asignatura pendiente, pero que cada vez se ve más cercana.
Existen proyectos en España, como (https://www.proyectomedea.es/) Medea, que ya ha comenzado a incluir estos ensayos en numerosos tratamientos en Extremadura, que comienzan a allanar el camino para una implantación total.
Conclusión
Los grandes beneficios que la farmacogenómica y la farmacogenética incluirían en nuestro sistema de salud justifican que su aplicación sea ya una necesidad y el futuro del sistema pasa por esta aplicación y la individualización de los tratamientos que traería consigo. El objetivo principal ahora es conseguir que los tratamientos farmacológicos habituales y crónicos se apoyen en la farmacogenómica y la farmacogenética como herramientas para su mejora. Con esto en mente, la obtención de tratamientos personalizados para cada paciente es posible, y está más próxima de lo que pensamos.
Bibliografía
Clinical Pharmacogenetics Implementation Consortium. (s. f.). https://cpicpgx.org/
Ho, T. T., Noble, M., Tran, B. A., Sunjic, K., Gupta, S. V., Turgeon, J., & Crutchley, R. D. (2023). Clinical Impact of the CYP2C19 Gene on Diazepam for the Management of Alcohol Withdrawal Syndrome. Journal of Personalized Medicine, 13(2), 285. https://doi.org/10.3390/jpm13020285
Król, Z. J., Dobosz, P., Ślubowska, A., & Mroczek, M. (2023). WGS Data Collections: How Do Genomic Databases Transform Medicine? International Journal of Molecular Sciences, 24(3), 3031. https://doi.org/10.3390/ijms24033031
Pharmacogenomics Global Research Network – Home. (s. f.). https://www.pgrn.org/
Proyecto Medea – Medicina Personalizada utiliza la información genética para optimizar la prescripción. (s. f.). https://www.proyectomedea.es/
Roden, D. M., McLeod, H. L., Relling, M. V., Williams, M. S., Mensah, G. A., Peterson, J. F., & Van Driest, S. L. (2019). Pharmacogenomics. The Lancet, 394(10197), 521-532. https://doi.org/10.1016/s0140-6736(19)31276-0
Tatonetti, N. P., Ye, P. P., Daneshjou, R., & Altman, R. B. (2012). Data-Driven Prediction of Drug Effects and Interactions. Science Translational Medicine, 4(125). https://doi.org/10.1126/scitranslmed.3003377
Vasiliu, O. (2023). The pharmacogenetics of the new-generation antipsychotics – A scoping review focused on patients with severe psychiatric disorders. Frontiers in Psychiatry, 14. https://doi.org/10.3389/fpsyt.2023.1124796
Whirl‐Carrillo, M., Huddart, R., Gong, L., Sangkuhl, K., Thorn, C. F., Whaley, R., & Klein, T. E. (2021). An Evidence‐Based Framework for Evaluating Pharmacogenomics Knowledge for Personalized Medicine. Clinical Pharmacology & Therapeutics, 110(3), 563-572. https://doi.org/10.1002/cpt.2350







