Alyssa, una joven británica de 13 años, fue diagnosticada con Leucemia Linfoblástica Aguda (o ALL, en inglés) hace unos años. Se trata de un cáncer de la sangre y de la médula ósea que afecta a los linfocitos T (un tipo de glóbulos blancos), con un pronóstico grave. Desde entonces, todas las terapias a las que se había sometido no dieron resultado alguno, tal y como ocurre en un triste porcentaje de estos pacientes.
Sin embargo, hace unas semanas el investigador y profesor de Harvard David Liu, y coinventor del Base editing, se hacía eco del milagro: Alyssa estaba sana, recuperándose en el hospital londinense Great Ormond Street y sin rastro de cáncer en su sangre. Todo gracias a una terapia novedosa con CAR-T, en tan solo seis meses. Como diría el doctor Michael Jansen: «Alyssa se ha vuelto inmune al cáncer».
Índice de contenido:
Las balas mágicas de Alyssa
En los últimos 30 años, los avances en la Ingeniería genética y en la Biología sintética han desmoronado verdaderamente toda percepción de límite que podíamos tener sobre nuestra capacidad de manipular la vida misma. Nuestra capacidad de alterar con minuciosa precisión cualquier letra, o nucleótido, de nuestro ADN y conseguir insertar y retirar exitosamente cualquier gen de un organismo, ha convertido a las células en verdaderos chasis robotizados que se comportan a nuestra voluntad. Nuestra imaginación es realmente la única barrera. Es, de hecho, esta imaginación la que nos ha llevado a noticias tan emocionantes como esta; donde estos robots celulares actúan como ‘balas mágicas’ al servicio terapéutico para hacer frente a la leucemia.
Como veremos, no deja de ser deliciosamente irónico que hayan sido las propias células de Alyssa, modificas genéticamente, las que han librado y ganado esta batalla contra el cáncer. Modificar los linfocitos T, generar CAR-T, y conseguir que estos luchen contra sí mismos, no es más que otra maravilla de la biomedicina, y un aviso de lo que está por venir. Así que, pongámonos manos a la obra y analicemos exactamente, ¿qué es una CAR-T?
Los componentes de las CAR-T
Empecemos definiendo conceptos, ¿qué significa CAR-T? Las siglas en inglés hacen referencia a receptor antigénico quimérico de Linfocito T, lo cual no ayuda demasiado a no ser que los desgranemos por partes. Una CAR-T se compone de al menos tres piezas:
- Un linfocito T que actuará como bala.
- Un anticuerpo que actuará de sensor.
- Y un mensajero, es decir, una estructura que permite al sensor decirle al linfocito que ataque sin piedad, diferenciando amigo de enemigo.
Es, por tanto, una única proteína creada a partir de trozos de diferentes proteínas, ergo; una quimera. Para entender cómo funcionan las CAR-T es buena idea imaginarlas de esta manera; modularmente, por piezas, donde cada una aporta su propia función (lo que se denomina técnicamente como abstracción) al resultado final; conseguir que células del paciente ataquen selectivamente al tumor, dejando indemnes al resto del tejido. ¿Complicado? Un poco, por eso lo mejor es que vayamos una por una.
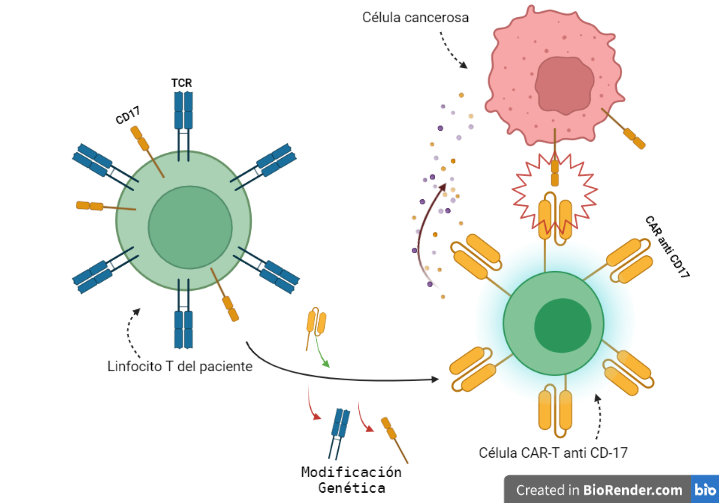
Con referencia a la figura anterior, los pasos para convertir los linfocitos T en CAR-T antitumorales son los siguientes:
- Se eliminaron las proteínas (TCR) que permiten detectar a los linfocitos los antígenos de manera natural, dejándolos ciegos temporalmente.
- También se eliminaron las dianas que se iban a utilizar contra el cáncer (CD17), volviéndolos inmunes a su propio reconocimiento.
- Se introdujo en los linfocitos el CAR, con su anticuerpo y mensajero (CAR anti CD17). Esto permitía al linfocito recuperar la visión pero de manera que solo pueda ver nuestra diana
De esta manera las CAR-T son capaces de atacar secretando toxinas (como perforinas y granzimas) a las células tumorales de la leucemia.
El Modus operandi de la terapia celular CAR-T
El linfocito es el perfecto ejecutor para nuestro sistema. Se trata de un leucocito, y como tal, es capaz de reconocer fisiológicamente antígenos (dianas), activarse y multiplicarse, generando un ingente número de clones en un fenómeno conocido como expansión clonal. Sin embargo, es la interacción con el antígeno lo que verdaderamente nos dará juego, flexibilidad y variedad.
Bien podríamos soñar con linfocitos T reguladores que, una vez alcanzado el antígeno, secretasen sustancias antiinflamatorias, regeneradoras tisulares e inhibidoras de la respuesta inmune para tratar enfermedades como la de Crohn, o la inflamación crónica, la artritis o el síndrome respiratorio grave (o SARS, infamemente conocido).
O quizás podríamos soñar con un linfocito T citotóxico que detectase y destruyera con sus perforinas a cualquier patógeno imaginable, o a la leucemia, o al cáncer ovárico, o al de páncreas. Al fin y al cabo, son nuestras propias células, somos nosotros mismos enfrentándonos al peligro.
No hablamos de fármacos químicos, de radioterapias o trasplantes. Es algo mucho más elegante; hablamos de decirles a nuestras células sobre qué deben actuar, de darles un pequeño empujón. El resto ya lo hacían perfectamente ellas solas, para eso son fruto de millones de años de evolución.
Entonces, ¿cómo reconoce el linfocito la diana que nosotros queremos? ¿Cómo podríamos inventar una proteína que reconociese a un antígeno, a una diana? Pues con un anticuerpo, claro. Ahora, el asunto tiene su arte, no vale cualquier anticuerpo ni tampoco cualquier antígeno.
En cuanto al primero, sería imposible usar uno convencional, ya que su gran tamaño y peso dificultaría que el pobre linfocito pudiera expresarlo junto al resto del CAR –sería como colgar una bola de bolos al hilo dental-, además de dificultar el acceso de este al antígeno.
El truco está en que realmente no queremos todo el anticuerpo, sino solamente la región de este que permite que existe esa unión antígeno-anticuerpo, una región llamada CDR –o región determinante de la complementariedad, en inglés-, por lo que es posible desarrollar anticuerpos chiquitines que mantengan toda esa fuerza de interacción y especificidad.
Alpacas y nanobodies
Estos ‘mini anticuerpos’ se suelen llamar, con excelente criterio, nanobodies. Lo cierto es que uno podría pensar que su obtención requiere de largos e intrincados procesos de síntesis química o, quizás, el uso de un tipo de microorganismo encontrado en no-sé-cuál caverna recóndita en la Antártida, pero dejando a un lado el sarcasmo, la realidad es mucho más sencilla: Alpacas. Sí, alpacas, suena a broma, pero has leído bien.
Estos y otros camélidos producen nanobodies de manera completamente natural. Solo hace falta inocularles el antígeno diana junto a un coadyuvante –como el de las vacunas-, esperar unas horas y purificarlos de su suero.
Las aplicaciones terapéuticas de la edición de bases no han hecho más que empezar, se están dando pasos clave para tomar el control de nuestros genomas.
Dr. David Liu
Ahora bien, ese solo lleva truco, cómo no. ¿Sirve cualquier antígeno? Evidentemente no. Y es que antes de nada se ha de dejar claro que un antígeno puede ser cualquier cosa, cualquier molécula con independencia de su complejidad o naturaleza química que sea expresada únicamente por lo que queremos atacar.
Y ahí está el truco, en el únicamente; la especificidad de nuestra CAR-T es tan buena como diferencial sea la expresión del antígeno. Debemos buscar uno diferencial, que sí tengan los tumores, pero no las células sanas. Es complicado, me temo; los tumores no son células ajenas, son las nuestras comportándose egoístamente, y cuanto más semejantes son dos organismos, más difícil resulta desarrollar una terapia diferencial, eficaz e inocua para el individuo.
Nuestra carrera contra el cáncer
Ya solo nos queda el último componente del sistema, pero no por ello de menor importancia: el mensajero. Puede parecer trivial, pero el estudio sobre qué y cuánto es necesario para la correcta activación del linfocito una vez reconocido el antígeno ha hecho correr ríos de tinta en la literatura científica.
De hecho, todavía no hay más que teorías al respecto de cómo se produce ese intercambio de información entre el receptor –llamado o TCR en linfocitos normales– y el mensajero. Lo que sí sabemos es que es necesaria la presencia de un mensajero principal llamado CD3, y otro secundario o coestimulador como el CD28. La bioquímica hilvanada en esta activación asesina es a la par preciosa y compleja. Si a todo esto, le añadimos la posibilidad de modificar genéticamente a estas CAR-T para hacerlas más reactivas, resistentes a quimioterápicos e inmunes a su citotoxicidad, tenemos un casi infinito abanico de posibilidades de mejora y personalización terapéutica.
Conclusión
La terapia celular, las CAR-T y la ingeniería genética nos han abierto a un mundo increíble lleno de posibilidades, un mundo en el que personas como Alyssa pueden tener esperanzas y, cuando todo lo anterior fracasa, la ciencia puede otorgarles una nueva oportunidad.
Artículo editado por Judith Quiñones
Bibliografía
- Noticia Original BBC: https://www.bbc.com/news/health-63859184
- Revisión de enfoque estructural y mecanístico, con posibles respuestas sobre la transducción de señal: Chang, Z. N. L., & Chen, Y. Y. (2017). CARs: Synthetic Immunoreceptors for Cancer Therapy and Beyond. Trends in Molecular Medicine, 23(5), 430–450. https://doi.org/10.1016/J.MOLMED.2017.03.002, https://pubmed.ncbi.nlm.nih.gov/28416139/
- Excelente revisión de las ventajas y limitaciones de la Terapia celular CAR-T: Sterner, R. C., & Sterner, R. M. (2021). CAR-T cell therapy: current limitations and potential strategies. Blood Cancer Journal 2021 11:4, 11(4), 1–11. https://doi.org/10.1038/s41408-021-00459-7, https://www.nature.com/articles/s41408-021-00459-7
- Artículo Reciente sobre la posibilidad de aplicación de CAR-T a otros tipos de cáncer sanguíneos: Cliff, E. R. S., Merryman, R. W., Armand, P., & Jacobson, C. A. (2022). Unresolved questions in the second-line use of CAR-T cells for diffuse large B cell lymphoma. Nature Medicine 2022, 1–2. https://doi.org/10.1038/s41591-022-02067-9, https://www.nature.com/articles/s41591-022-02067-9
- Excelente revisión sobre las técnicas de edición genética basadas en CRISPR: Chen, P. J., & Liu, D. R. (2022). Prime editing for precise and highly versatile genome manipulation. Nature Reviews Genetics 2022, 1–17. https://doi.org/10.1038/s41576-022-00541-1, https://www.nature.com/articles/s41576-022-00541-1
- Vídeo Linfocitos T: Cambridge University. (2015, 19 mayo). Killer T Cell: The Cancer Assassin [Vídeo]. YouTube. https://www.youtube.com/watch?v=ntk8XsxVDi0
- Genial Charla TedX (YouTube) del Dr.Michael Jensen sobre la terapia CAR-T: https://www.youtube.com/watch?v=3kiDfLS0UXQ
Foto portada modificada a partir de Aideal Hwa en Unsplash.







