El Alzheimer es la enfermedad neurodegenerativa de mayor importancia a nivel mundial, afectando a unos 24 millones de personas y llevando asociado un gasto de más de 1,2 billones de euros anuales. Se espera que estas cifras se eleven durante los años venideros con el aumento de la vida media de la población, pudiendo cuadruplicarse o quintuplicarse el número de afectados por esta demencia. Esta situación hace que la investigación de esta patología se convierta en una prioridad médica, y más considerando que no existen todavía tratamientos en uso para curar esta enfermedad, por lo que sólo se tratan los efectos de esta.
En este artículo se dará una visión general de los conocimientos actuales sobre el Alzheimer y se analizará la relación que existe entre este y el sueño. Este problema se abordará tanto: desde la prespectiva de que el Alzheimer produce trastornos en los ritmos circadianos (parámetros biológicos que siguen un patrón que se repite cada 24 horas) de los pacientes como desde el enfoque que propone a las anomalías en los periodos de sueño como factores de riesgo y/o posibles marcadores del futuro desarrollo de Alzheimer en gente que todavía no presenta la enfermedad.
Índice de contenido:
¿Qué sabemos del Alzheimer? Etapas
Se trata de un tipo de demencia que suele aparecer en personas de edad avanzada. Se observa un continuo deterioro de la actividad cerebral con manifestaciones como los fallos en la memoria, cambios en la personalidad, trastornos de sueño, depresión…Se clasifica en tres etapas según la progresión de la patología:
1. La primera etapa o etapa preclínica se desarrolla años antes de que aparezcan los primeros síntomas de la enfermedad. Se comienza a producir daño cerebral, que sólo se manifestará como una leve pérdida de memoria a corto plazo o algunas dificultades para dormir bien. Durante esta fase no se puede detectar la enfermedad mediante exámenes cognitivos, pero sí que empiezan a alterarse los niveles de algunos biomarcadores, que podrían servir como alarma para prever un futuro desarrollo de la enfermedad.

Este fenómeno en el que se produce deterioro en un órgano pero no se observan síntomas es algo muy común en los pacientes de diversas enfermedades y se debe a la llamada ‘reserva funcional‘. Dicha reserva puede entenderse como el daño que puede resistir un órgano sin dejar de realizar correctamente su función, pero, ¿qué ocurre cuando esta reserva se agota?
2. La segunda etapa, llamada leve o temprana es la manifestación del daño neurológico una vez superada la reserva funcional. Durante esta fase, la enfermedad comienza a interferir con la vida cotidiana del paciente, causando fallos en la memoria a largo plazo, desorientación y desorganización, dificultad para concentrarse, fallo en el pensamiento abstracto y el juicio…
Todas estas manifestaciones hacen muy difícil para el enfermo la realización de tareas cotidianas y llevan asociados cambios en el estado anímico y en la conducta social. En general, los pacientes pueden presentar apatía, agitación, deambulación, psicosis y deshinibición. En estas personas aumenta significativamente el riesgo de sufrir aislamiento social y de desarrollar depresión. Cuando esta fase ya se encuentra avanzada, aparecen problemas visuoespaciales y trastornos en el lenguaje.

3. La tercera y última etapa, que recibe el nombre de demencia. Durante esta se producen trastornos en el sueño, se olvidan tareas motoras aprendidas (dificultades al comer, al vestirse…), se producen contracciones musculares involuntarias, temblores, movimientos lentos y, cuando la enfermedad avanza, se producen fallos en funciones primitivas (tragar, orinar…) que harán al paciente dependiente de cuidadores al no poder valerse por sí mismo y podrán llevar a la muerte de este al poder producir complicaciones.

¿Qué ocurre en una persona con Alzheimer?
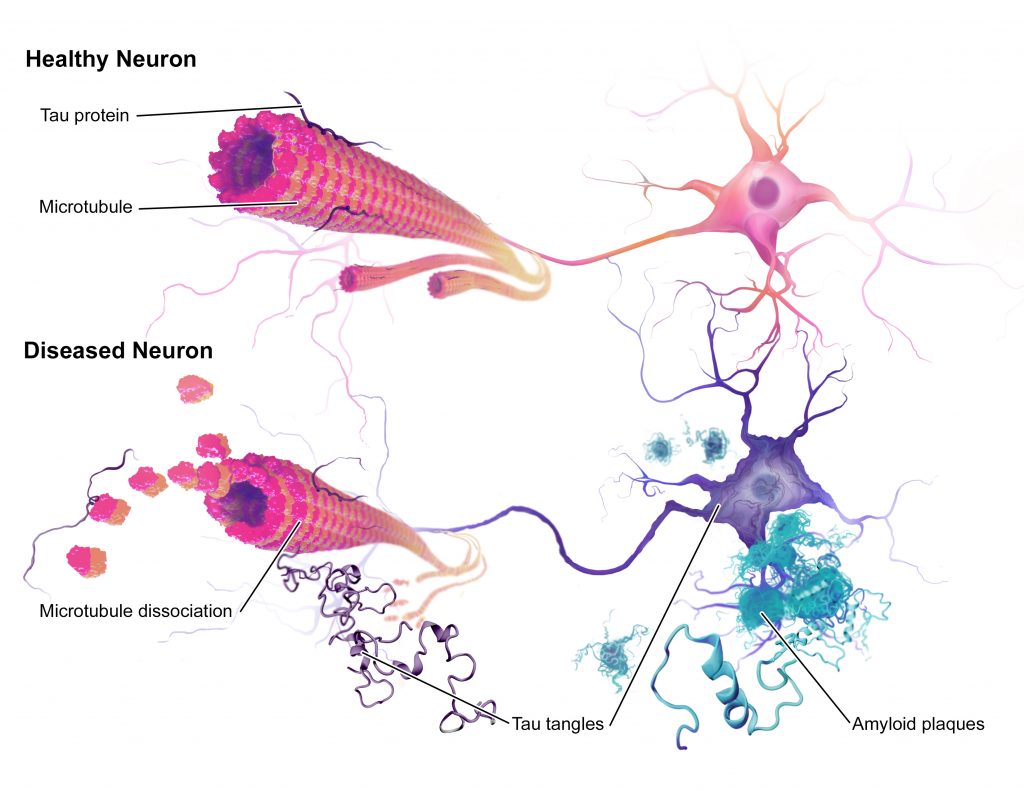
Básicamente, lo que se produce es una pérdida de la función de las neuronas y la muerte de estas, sobre todo en la zona de la corteza cerebral y el hipocampo (estructura del sistema límbico situada en el lóbulo temporal, en la parte interna del cerebro, cuya función principal es la generación y recuperación de recuerdos) lo que se traduce en los síntomas que observamos en los pacientes, pero… ¿qué es lo que mata o impide que las neuronas desarrollen sus funciones normales?
Existen dos responsables principales: las palcas amiloides y los ovillos de Tau.
-En nuestro sistema nervioso hay varias proteínas esenciales para que las sinapsis se produzca correctamente, una de ellas llama proteína precursora amiloide y se encuentra en las membranas celulares. Para que pueda realizar su función, esta tiene que ser cortada en piezas más pequeñas y funcionales llamadas amiloides.
En pacientes con alzheimer, las enzimas que actúan como ‘tijeras’ de la proteína precursora amiloide comienzan a producir amiloides más largos que en pacientes sanos, aumentando la cantidad del llamado beta amiloide de 42 aminoácidos (los aminoácidos son los elementos que componen las proteínas). Si la concentración de este aumenta demasiado, se empiezan a formar acumulaciones de estas sustancias en el espacio extracelular. Para medir este riesgo se suele utilizar la relación entre amiloides con 40 aminoácidos (más numeroso en pacientes sanos) y amiloides con 42 aminoácidos.
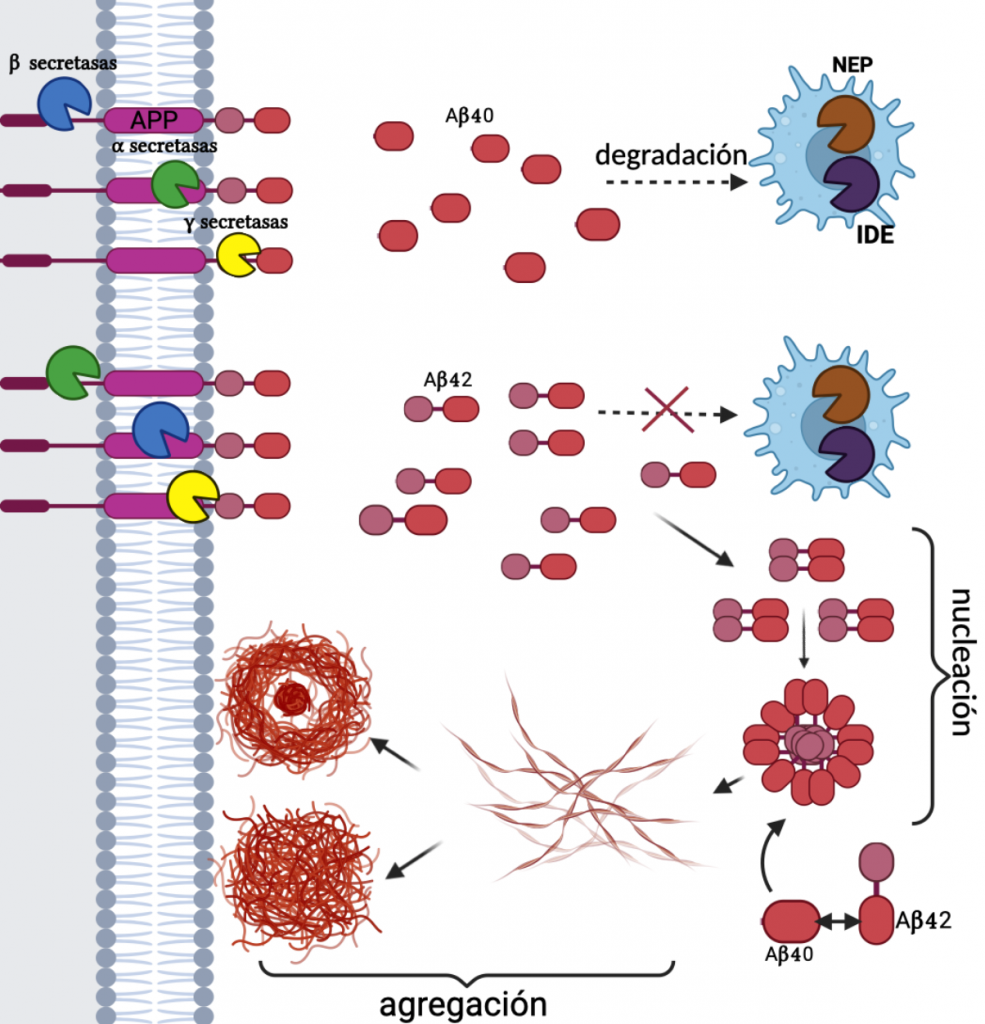
Estos depósitos de amiloides disminuyen el espacio que hay disponible entre las neuronas, pudiendo producir la muerte de estas, la activación del sistema de defensa cerebral (llamado neuroglia), que puede producir inflamación y dañar a las neuronas y la formación de ovillos de Tau, que en breve explicaremos.
Hay que destacar que, aunque se sabe que estas placas amiloides están fuertemente relacionadas con el Alzheimer, no siempre lo producen, ya que se han encontrado personas con estas formaciones que no presentaban la enfermedad.
-Para poder transmitir los impulsos nerviosos, las neuronas tienen que hacer uso de unas sustancias llamadas neurotransmisores. Las neuronas poseen un armazón interno formado por proteínas y tubos microscópicos, que tienen la capacidad de funcionar como «cintas transportadoras» de neurotransmisores hacia la zona en la que se van a liberar. Una de las proteínas que forma este armazón es la Tau, que en condiciones normales estabiliza a estos tubos para que funcionen corréctamente.
Esta proteína se regula mediante una serie de mecanismos, que si fallan, hacen que la proteína pase de tener una forma lineal a tener forma de ovillos. La formación de estos ovillos en el interior de las neuronas dificulta el transporte de los neurotransmisores, afectando a la transmisión del impulso neuronal.
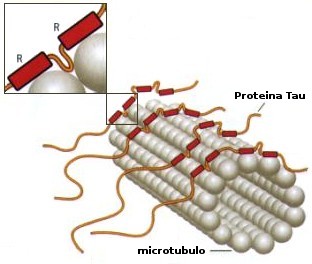
Los ovillos de Tau están relacionados con las placas de amiloide, ya que la formación de estas placas puede producir estos fallos en la regulación de Tau.
Ambos sucesos, junto con otras condiciones de la enfermedad, como la inflamación, tienen en común que disminuyen la funcionalidad neuronal, lo que explica que su presencia produzca los síntomas de los pacientes de Alzheimer.
¿Cuáles son los principales factores de riesgo?
El principal factor de riesgo de esta enfermedad es la edad avanzada, aunque también se ha demostrado que la depresión, la edad avanzada de los padres al tener a sus hijos, las lesiones en la cabeza, así como las enfermedades vasculares y algunas infecciones pueden aumentar el riesgo de aparición de Alzheimer. Algunos contaminantes, como los metales pesados, parecen aumentar también dicho riesgo.
En cuanto a la genética, se sabe que hay varios genes implicados en la herencia de esta enfermedad. Así, la información genética con la que cada uno nacemos puede condicionar la aparición de Alzheimer. Algunos de los genes implicados en esta enfermedad pueden dar información casi segura de que la persona va a desarrollarla, mientras que otros aumentan la predisposición a esta patología, pero en menor medida.
El estilo de vida también influye en el riesgo de padecer esta enfermedad, y es que el ejercicio físico habitual, una buena rutina de sueño, la ausencia de tabaquismo, una dieta saludable y la realización de actividades como la lectura o tocar instrumentos reducen el riesgo de padecer Alzheimer.
¿Qué tiene que ver el sueño con esta patología?
Antes de establecer las relaciones entre estos dos conceptos, es importante que sepamos qué ocurre mientras dormimos. El sueño se divide en varias etapas, que englobaremos en:
Etapas de sueño REM. Estas siglas provienen del inglés y significan «rapid eye movement», ya que en esta etapa del sueño se producen movimientos rápidos en los ojos. Es la etapa de sueño más profundo, en la que se producen los sueños y se llevan a cabo la mayor parte de las tareas de regulación del organismo durante el descanso, como es la activación del sistema glinfático. Se paraliza la actividad muscular.
Etapas de sueño no REM. En estas, los ojos se mueven lentamente y la actividad muscular se reduce. Se divide en 4 fases que aumentan la desconexión con los estímulos exteriores y comienzan a activar algunos procesos neuronales como la consolidación de la memoria a largo plazo a medida que evolucionan hacia la fase REM.
La primera es la más importante en cuanto a las funciones del descanso y es en la que nos vamos a centrar en este apartado. Para más información sobre este proceso, consultad este artículo.
El sueño es un proceso fundamental en el que se regulan las condiciones del organismo y se organiza la información generada durante el día, produciéndose cambios en las sinapsis neuronales que modifican nuestra memoria, pudiendo llevar parte de la información reciente que retenemos en la memoria a corto plazo hasta la memoria a largo plazo.
Otro importante evento que se produce durante las horas de sueño es la activación del sistema glinfático para el transporte de los residuos presentes en el encéfalo hasta la sangre y de esta al hígado, donde son degradados. Pero, ¿en qué consiste exáctamente este sistema?
Nuestas células están produciendo desechos continuamente en todos nuestros tejidos, en los que generalmente hay una corriente de líquido que circula por el exterior de las células y permite la recogida de sus desechos a la vez que aporta a estas los nutrientes necesarios para su correcto funcionamiento. Este líquido escapa de nuestros vasos sanguíneos y, tras realizar su recorrido para la recogida de desechos, es colectado por el sistema linfático, que lo lleva de vuelta a la circulación sanguínea.
En el encéfalo, este sistema no es posible, ya que no tiene sistema linfático para recircular el líquido que sale de los vasos sanguíneos. Ante esta necesidad, existen unas células llamadas astrocitos que han adquirido la capacidad de drenar el líquido que discurre entre las neuronas y células de la glia. Al poder devolver el líquido a la sangre, se genera una corriente desde los vasos sanguíneos hasta los astrocitos capaz de arrastrar todos los residuos celulares y de aportar nutrientes a las células para el metabolismo celular.
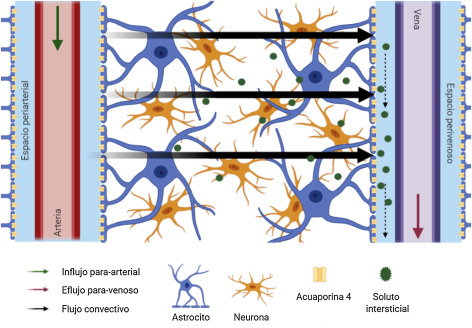
Este sistema tiene diversas peculiaridades, pero hay una en concreto que nos va a interesar para nuestro artículo: depende del tiempo y calidad del descanso.
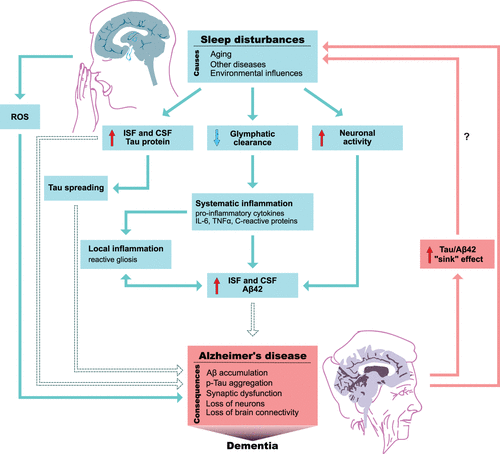
Cuando una persona está despierta, sus neuronas se encuentran activas, produciendo una gran cantidad de desechos, y los espacios entre las células son muy estrechos, por lo que el paso del líquido por estos es difícil. Durante la fase REM del sueño, sin embargo, aumenta el tamaño de los huecos entre las células y el líquido circula con mayor facilidad, permitiendo una mayor corriente. La eliminación del exceso de beta amiloide evita que se formen placas de amiloide.
En situacones de privación de sueño, se ha observado que los niveles de amiloide en el líquido cefalorraquídeo (el nombre que recibe el anteriormente tratado líquido que discurre entre las células nerviosas y las de la glia) aumentan significativamente al no pasar por una etapa de eliminación de los residuos celulares.
Pero, ¿qué es exáctamente lo que tiene el sueño para activar este mecanismo de detoxificación? ¿Hay algún factor más que intervenga en este proceso?
Para responder a esta cuestión se han realizado numerosos experimentos probando diversos factores que se cree que podían estan involucrados en este proceso.
El primer factor a tratar son los ritmos circadianos, y es que se sabe que hay momentos del día en los que se acumula más beta amiloide, pero… ¿Es esto debido a la propia hora del día? ¿Al efecto que causa la exposición a la luz o la oscuridad a nuestro cerebro? ¿Son las hormonas que regulan el estado de sueño o vigía las que intervienen en la activación del sistema glinfático?
Los resultados de las experiencias realizadas apuntan a que es este último factor el encargado de activar este sistema de recogida de desechos. La luz y la hora del día no han tenido un impacto claro en la acumulación de amiloides. Entre las hormonas implicadas, las más importantes son la orexina y la melatonina.
La orexina es una hormona que estimula el estado de vigía, es decir, nos mantiene despiertos y alerta. Se han asociado altas concentraciones de esta enzima con un aumento de los beta amiloides, es decir, a mayor activación de la vigía, más rápida es la acumulación de amiloide.
La melatonina, al contrario que la orexina, es una hormona cuya concentración es inversamente proporcional a la acumulación del amiloide. La función de la melatonina es regular el ciclo del sueño, y suele aumentar su concentración unas dos horas antes del descanso.

Otro elemento a analizar, dejando a un lado las placas amiloides, es la proteína Tau y la inflamación, claves también en la aparición de esta enfermedad.
Los recientes estudios de la proteína Tau durante el sueño y la vigía han demostrado que la formación de ovillos está asociada a la falta de sueño, al igual que, como hemos dicho anteriormente, ocurre con los depósitos de beta amiloide.
La inflamación ha sido abordada desde dos prespectivas distintas:
La primera de ellas es el estudio de las citoquinas proinflamatorias, que son sustancias encargadas de la aparición de la inflamación. Estas citoquinas aumentan su presencia con la privación del sueño, favoreciendo la aparición de inflamación.
El otro elemento relacionado con la inflamación son las células de la glia, concretamente los astrocitos y las microglías. La falta de sueño afecta negativamente a estas células, pudiendo dificultar su función que es la nutrición, protección y eliminación de los desechos de las neuronas.
Un último factor a tener en cuenta son las especies reactivas de oxígeno. Estas son unas moléculas producidas en diversas enfermedades y situaciones de estrés cuya concentración aumenta al disminuir las horas de sueño.
Como hemos podido observar, la privación de sueño o la mala calidad de este puede generar un ambiente idóneo para el desarrollo de Alzheimer. Estas evidencias apuntan a que un descanso insuficiente podría ser un importante factor de riesgo para esta enfermedad, así como otro tipo de demencias menos prevalentes. A todo esto hay que sumarle el efecto que produce la fatiga generada por la falta de sueño, que dificulta las tareas y los procesos cognitivos, pudiendo agravar los síntomas de esta enfermedad si es que ya se han presentado en el paciente.
Hasta aquí hemos utilizado los descubrimientos más recientes para relacionar la falta de sueño con la aparición de Alzheimer, pero esto es sólo una de las caras de la moneda. Es bien sabido por las personas que han tenido que lidiar con esta enfermedad en su entorno o en su propia persona que el Alzheimer produce trastornos de sueño, cambios en los horarios de sueño y vigía y otros síntomas relacionados con un descanso de mala calidad. ¿Por qué ocurre esto?
En el cerebro hay varias áreas encargadas de regular los ciclos de sueño-vigía y algunos ritmos circadianos relacionados con el sueño. Estas áreas resultan dañadas durante el desarrollo de la enfermedad, por lo que el paciente comienza a tener problemas para dormir y la rutina de sueño empieza a cambiar. Se suelen producir noches de poco descanso y aparece la necesidad de dormir largas siestas para compensar el tiempo de sueño insuficiente. Dichas siestas hacen que el descanso por la noche sea más difícil y se termina produciendo una situación en la que los pacientes no distinguen correctamente el día de la noche y pierden los hábitos de descanso.
Otra alteración del sueño característica del Alzheimer es, por ejemplo, el síndrome de la puesta de sol. Este fenómeno se produce cuando anochece, momento en el que los pacientes comienzan a experimentar desorientación especial y temporal, pudiendo mostrarse agresivos, inquietos o sufriendo periodos de ansiedad sin causa aparente. Es frecuente que los pacientes con este síndrome quieran abandonar el centro en el que reciben cuidados porque piensan que «ya es tarde y deben volver a casa» o que tienen que avisar a sus padres de que llegarán tarde a casa porque «les están esperando para cenar».

Un tercer ejemplo de alteración del sueño es el aumento de movimientos bruscos nocturnos del paciente, que hacen que puedan dañarse por golpes o por caídas de la cama. Esto puede ser peligroso también para los cuidadores, que pueden resultar dañados por estos movimientos nocturnos al acudir a atender al paciente.
Existen otros muchos casos descritos de alteraciones que dificultan el descanso en los pacientes, produciendo en general agotamiento durante el día, que dificulta las tareas cotidianas.
Experimentos recientes apuntan a que no sólo estos trastornos están causados por el deterioro de los centros de control del sueño, sino que algunos de los fenómenos propios del Alzheimer tienen por sí solos capacidad de afectar a la calidad del sueño.
Este es el caso, por ejemplo de las placas amiloides y los ovillos de Tau, que dificultan la función neuronal y afectan negativamente al descanso. Algunos síntomas de la enfermedad como la incontinencia nocturna o la nicturia producen fraccionamiento del sueño, dificultando todavía más el descanso.
Como hemos podido comprobar, la enfermedad de Alzheimer produce numerosos trastornos en el sueño de los pacientes, que afectan a la calidad de vida de los pacientes y agravan los síntomas de la enfermedad. Se ha sugerido que, ya en la fase preclínica, esta enfermedad podría producir trastornos de sueño en pacientes que todavía no han sido diagnosticados y que pueden tardar todavía varios años en desarrollar la fase clínica enfermedad.
Englobando todo lo visto hasta ahora, podemos considerar que entre los trastornos en el sueño y la enfermedad de alzheimer existe una relación bidireccional. Esto implica que el Alzheimer produce trastornos de sueño y los trastornos de sueño pueden ser un factor de riesgo para desarrollar la enfermedad, o incluso ser el primer síntoma que aparezca de la enfermedad cuando esta se encuentra en fase preclínica.
La bidireccionalidad de este proceso puede producir peligrosos ciclos de retroalimentación en los que el avance del Alzheimer disminuye la calidad del sueño, y esta a su vez afecta al desarrollo de esta enfermedad. Todavía hay mucho que investigar en este ámbito, pero parece que el control de unos buenos hábitos de descanso en los pacientes podría ser crucial para evitar en la medida de lo posible el avance de la enfermedad de una manera relativamente fácil y no invasiva.
Entonces, ¿dormir mucho tiempo hace que no desarrolles Alzheimer?
En los estudios realizados, se observan unas condiciones idóneas en las personas que duermen entre 7 y 9 horas. Cuando las horas de sueño disminuyen por debajo de las 7 ya comienzan a aumentar los parámetros de riesgo para el desarrollo de Alzheimer. Paradójicamente, se ha observado que una rutina de sueño de más de 10 horas diarias puede tener las mismas consecuencias que la falta de sueño, aunque debido a otros parámetros.
En vista a estos resultados, hay que considerar el correcto horario de sueño un hábito muy importante en cuanto a prevención de enfermedades, cuya duración óptima depende de la persona y la edad, pero no hay que excederse, ya que puede obtenerse el resultado opuesto al esperado.
Conclusión
El Alzheimer es una de las enfermedades con mayor importancia en la actualidad debido a su alta incidencia, a sus enormes costes económicos y personales y debido a que no se dispone de ningún tratamiento efectivo para la enfermedad. Este contexto hace que sea de vital importancia encontrar estrategias y rutinas que retrasen la aparición y progresión de la enfermedad o que prevengan de su aparición.
Uno de los hábitos que se ha propuesto para el estudio de su implicación en la enfermedad es el sueño, tanto la variación de su duración como su calidad.
Diversos experimentos han demostrado que no sólo está relacionado con la mayoría de los elementos de la enfermedad, sino que puede tener una futura aplicación terapeútica prometedora, funcionando incluso para detectar a potenciales pacientes de Alzheimer.
Aún queda mucho por aprender sobre esta enfermedad, en los últimos años se ha avanzado mucho en la comprensión del mecanismo molecular y se han abierto nuevas prespectivas para su estudio (introducción a los nuevos métodos de estudio de la enfermedad en animales transgénicos en el este artículo). Los próximos años serán determinantes en la lucha contra esta demencia y en el desarrollo de un fármaco que pueda combatirla.
“Sin memoria, no somos”.
Luis Rojas Marcos
Artículo editado por Equipo de Microbacterium
Bibliografía
Kumar A, Sidhu J, Goyal A, et al. Alzheimer Disease. [Updated 2022 Jun 5]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK499922/
Breijyeh Z, Karaman R. Comprehensive Review on Alzheimer’s Disease: Causes and Treatment. Molecules. 2020 Dec 8;25(24):5789. doi: 10.3390/molecules25245789. PMID: 33302541; PMCID: PMC7764106. From: https://pubmed.ncbi.nlm.nih.gov/33302541/
Kang JE, Lim MM, Bateman RJ, Lee JJ, Smyth LP, Cirrito JR, Fujiki N, Nishino S, Holtzman DM. Amyloid-beta dynamics are regulated by orexin and the sleep-wake cycle. Science. 2009 Nov 13;326(5955):1005-7. doi: 10.1126/science.1180962. Epub 2009 Sep 24. PMID: 19779148; PMCID: PMC2789838. From: https://pubmed.ncbi.nlm.nih.gov/19779148/
Shenker JI, Singh G. Sleep and Dementia. Mo Med. 2017 Jul-Aug;114(4):311-315. PMID: 30228618; PMCID: PMC6140093. From: https://pubmed.ncbi.nlm.nih.gov/30228618/
Zisapel N. New perspectives on the role of melatonin in human sleep, circadian rhythms and their regulation. Br J Pharmacol. 2018 Aug;175(16):3190-3199. doi: 10.1111/bph.14116. Epub 2018 Jan 15. PMID: 29318587; PMCID: PMC6057895. From: https://pubmed.ncbi.nlm.nih.gov/29318587/
Recuerda 22 – Alzheimer y sueño: ¿el huevo o la gallina? – YouTube. (n.d.). Retrieved March 24, 2023, from https://www.youtube.com/watch?v=U4Unhsxx4nU&ab_channel=Fundaci%C3%B3nPasqualMaragall
Ning, S., & Jorfi, M. (2019). NEURO FORUM Nervous System Pathophysiology Beyond the sleep-amyloid interactions in Alzheimer’s disease pathogenesis. J Neurophysiol, 122, 1–4. https://doi.org/10.1152/jn.00118.2019
Abramov, E., Dolev, I., Fogel, H. et al. Amyloid-β as a positive endogenous regulator of release probability at hippocampal synapses. Nat Neurosci 12, 1567–1576 (2009). https://doi.org/10.1038/nn.2433
Leng Y, Ackley SF, Glymour MM, Yaffe K, Brenowitz WD. Genetic Risk of Alzheimer’s Disease and Sleep Duration in Non-Demented Elders. Ann Neurol. 2021 Jan;89(1):177-181. doi: 10.1002/ana.25910. Epub 2020 Oct 5. PMID: 32951248; PMCID: PMC8048405. From: https://pubmed.ncbi.nlm.nih.gov/32951248/
Xie L, Kang H, Xu Q, Chen MJ, Liao Y, Thiyagarajan M, O’Donnell J, Christensen DJ, Nicholson C, Iliff JJ, Takano T, Deane R, Nedergaard M. Sleep drives metabolite clearance from the adult brain. Science. 2013 Oct 18;342(6156):373-7. doi: 10.1126/science.1241224. PMID: 24136970; PMCID: PMC3880190. From: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3880190/
Wang C, Holtzman DM. Bidirectional relationship between sleep and Alzheimer’s disease: role of amyloid, tau, and other factors. Neuropsychopharmacology. 2020 Jan;45(1):104-120. doi: 10.1038/s41386-019-0478-5. Epub 2019 Aug 13. PMID: 31408876; PMCID: PMC6879647. From: https://pubmed.ncbi.nlm.nih.gov/31408876/
Pak VM, Paul S, Swieboda D, Balthazar MS, Wharton W. Sleep duration and biomarkers of inflammation in African American and white participants with a parental history of Alzheimer’s disease. Alzheimers Dement (N Y). 2022 Sep 14;8(1):e12332. doi: 10.1002/trc2.12332. PMID: 36177446; PMCID: PMC9473642. From: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9473642/
Toriello M, González-Quintanilla V, Pascual J. El sistema glinfático y su implicación en las enfermedades del sistema nervioso,Medicina Clínica,Volume 156, Issue 7,2021,Pages 339-343,
ISSN 0025-7753, https://doi.org/10.1016/j.medcli.2020.08.020.





