Los ácidos grasos son componentes esenciales de los lípidos (un grupo de moléculas biológicas) y grandes aliados de nuestra salud y bienestar. Es muy probable que hayas oído hablar de los ácidos grasos omega 3, conocidos como ácidos grasos esenciales porque solo podemos obtenerlos consumiéndolos en la dieta.
Los ácidos grasos omega 3 se obtienen sobre todo del pescado y marisco, pero su demanda creciente ha generado la necesidad de buscar nuevas fuentes, eficientes y sostenibles, para obtenerlos.
Índice de contenido:
Importancia de los ácidos grasos omega 3
En los mamíferos se distinguen dos grupos de ácidos grasos esenciales: los omega 3 y los omega 6. Ambos son necesarios para el correcto desarrollo y funcionamiento de cerebro y corazón, además de mantener el equilibro general de los tejidos y órganos.
Sin embargo, los hábitos alimentarios actuales han cambiado drásticamente, llevando a una marcada reducción en el consumo de ácidos grasos omega 3. Aunque la proporción omega 6: omega 3 debería ser 4:1, se estima que en las dietas occidentales la concentración de omega 6 llega a ser hasta 20 veces superior a la de omega 3 (Simopoulos, 2006).
Son distinguibles tres tipos distintos de ácidos grasos omega 3: el ALA (ácido alfa-linolénico), el DHA (ácido docosahexaenoico) y el EPA (ácido eicosapentaenoico), siendo estos dos últimos los de mayor interés biomédico.
Los beneficios del DHA y EPA han sido evaluados extensivamente por la comunidad científica. Ambos se han relacionado con la prevención del riesgo de padecer enfermedades cardiovasculares (Shahidi y Ambigaipalan, 2008). Curiosamente, esta correlación fue observada originalmente en los esquimales de Groenlandia, cuya dieta se fundamenta en el consumo de pescado azul.
Sin embargo, los últimos estudios retrospectivos destacan que este efecto cardioprotector puede no ser tan importante como se creía, por lo que todavía existe controversia (Aung et al., 2018). Con todo y ello, la evidencia científica sí destaca su importancia en el desarrollo de la retina y el cerebro, particularmente importante en la infancia.
Dada la importancia de los ácidos grasos omega 3, los expertos coinciden en la necesidad de consumir al menos 250 mg de EPA y DHA al día en la población adulta, lo que se corresponde con unas dos piezas de pescado azul por semana (EFSA).
Fuentes clásicas de omega 3
Origen vegetal
El ácido graso ALA está presente en las nueces, los cacahuetes o las semillas de colza, soja y lino, entre otros. Sin embargo, las semillas y los aceites vegetales no son una fuente natural de ácidos grasos de cadena larga, como el EPA y el DHA. Además, la conversión del ALA en EPA y DHA en el organismo humano es posible, pero extremadamente ineficiente.
Origen pesquero
Los peces de aguas profundas y el marisco constituyen la más importante fuente de los ácidos grasos omega 3 de cadena larga (es decir, del EPA y DHA), ya sea mediante su consumo directo o a través de cápsulas de aceites de pescado. Lo más curioso es que los propios peces no son capaces de sintetizar estos ácidos grasos, sino que su acumulación se debe a la ingesta de microalgas. Este es el caso, por ejemplo, de peces como las sardinas y el boquerón u otros de mayor tamaño como el salmón, el atún y el pez espada.
A pesar de ser la fuente de omega 3 por excelencia, la explotación de los recursos pesqueros no está exenta de limitaciones. Cabe destacar el riesgo que implica la caza masiva, comprometiendo la biodiversidad de los océanos. Además, los aceites de pescado pueden contener trazas de metales pesados y suelen tener olores y sabores desagradables para el consumidor.
No debemos olvidar que la producción de pescado ha de responder a la demanda de una población creciente, lo que ha potenciado el desarrollo de las piscifactorías durante la última década. De hecho, más del 50% de los productos pesqueros actuales derivan de las granjas acuícolas. Debido a que los vertebrados, incluyendo los peces, carecen de las herramientas necesarias para la producción natural de omega 3, su consumo es también esencial en estos organismos.
Paradójicamente, la alimentación de muchas de las especies de piscifactoría se ha sustentado en el consumo de peces de pequeño tamaño y aceites de pescado ricos que les aporten omega 3. De hecho, hasta un 75% del aceite de pescado producido a nivel mundial se utiliza únicamente para abastecer a la acuicultura. A pesar de todo, las fuentes actuales de estos aceites han alcanzado niveles máximos desde el punto de visto de la sostenibilidad.
No es de extrañar que la comunidad científica haya centrado el foco de atención en el desarrollo de alternativas sostenibles y eficientes para aportar ácidos grasos DHA y EPA.
Desarrollando nuevas fuentes de omega 3
El aceite de krill: producto de moda
Dado que los productores primarios de prácticamente todos los ácidos grasos omega 3
son las microalgas y las bacterias marinas, son múltiples las iniciativas científicas que tienen como objetivo seleccionar nuevas fuentes de omega 3 en los ambientes marinos.
Uno de los abordajes propuestos es la utilización de especies de zooplancton capaces de acumular elevadas concentraciones de ácidos grasos omega 3. Actualmente los krill del Antártico son prácticamente las únicas especies que tienen un verdadero interés comercial (Tocher, 2015). De hecho, los aceites de krill se comercializan como suplementos nutracéuticos de gran valor, ya que en su formulación los ácidos grasos se encuentran combinados con fosfolípidos que mejoran la absorción en el tracto digestivo.
Microalgas: una mirada hacia el futuro
Las microalgas se postulan como una alternativa sostenible para la producción en masa de ácidos grasos omega 3, con diversos casos de éxito y múltiples investigaciones en desarrollo.
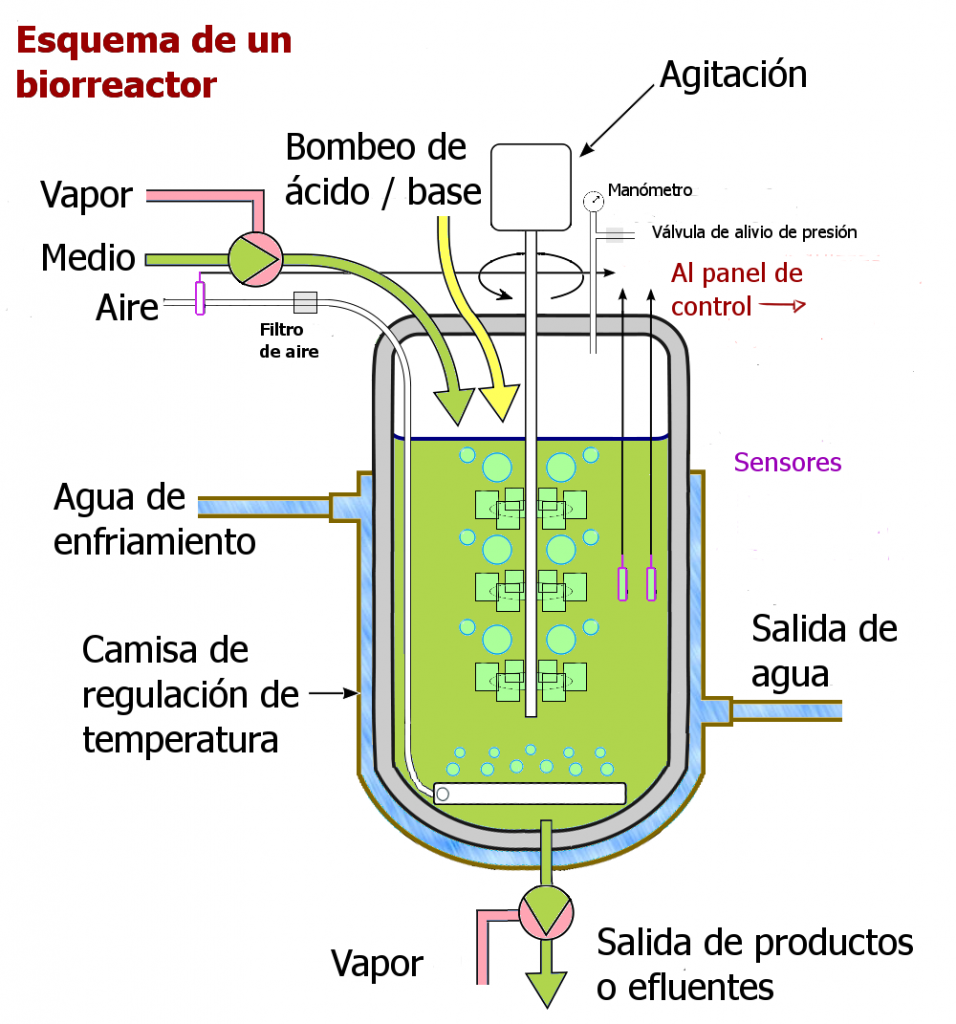
Es destacable el cultivo de algas heterotróficas para la producción de DHA. El concepto de “heterotróficas” implica que estos microorganismos necesitan una fuente de carbono externa para obtener energía. En este caso la producción de los ácidos grasos se lleva a cabo en biorreactores, donde las microalgas son cultivadas en condiciones controladas (nutrientes, temperatura, oxígeno disuelto, etc.) para maximizar la síntesis de omega 3.
Distintos tipos de microalgas ya están siendo utilizadas en las piscifactorías para proveer al sector de piensos ricos en EPA y DHA durante la cría de larvas de crustáceos y peces (Miller et al., 2006; Wang et al., 2017). En la alimentación humana también encontramos ejemplos de éxito como el de la empresa Novosana, conocida por comercializar un suplemento omega 3 vegano a partir de aceite de la microalga marina Schizochytrium sp.
Sin embargo, una de las principales limitaciones encontradas en la utilización de las microalgas es que gran parte de las especies conocidas no son capaces de producir el EPA y el DHA de forma simultánea. Consecuentemente, son múltiples los esfuerzos realizados en la búsqueda de microrganismos capaces de generar ambos compuestos.
Uno de los casos de éxito es el de la empresa Veramis, proyecto conjunto entre la multinacional holandesa DSM y la alemana Evonik que comercializa desde el 2018 un aceite rico en DHA y EPA a partir de una especie natural de microalga (Veramis).
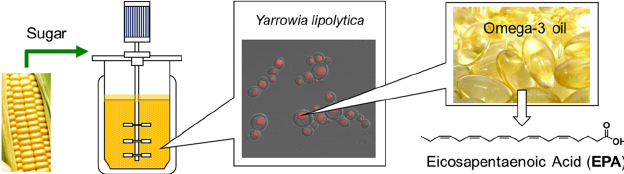
Por otro lado, la multinacional DuPont ha aplicado un abordaje puramente biotecnológico para la síntesis a gran escala de EPA. En este caso se llevó a cabo la modificación genética de una levadura, conocida como Yarrowia lipolytica, mediante la inserción del conjunto de genes implicados en la síntesis del EPA (Xie et al., 2009). Este tipo de abordajes se conocen como ‘ingeniería metabólica‘, una rama científica relativamente nueva (surgida en los años 90) basada en el diseño de rutas bioquímicas completas para otorgar a un organismo de nuevas capacidades a partir del conocimiento existente en la naturaleza.
Cultivos vegetales transgénicos
Los cultivos vegetales terrestres permiten producir anualmente casi 200 millones de toneladas de aceites vegetales. Sin embargo, no son capaces de generar ácidos grasos poliinsaturados omega-3 de cadena larga, como el EPA y el DHA. Consecuentemente, muchos grupos de investigación se han propuesto aplicar las tecnologías de clonación y modificación genética para la obtención de cultivos de plantas oleaginosas transgénicas que presenten esta capacidad.
Este tipo de abordajes requiere superar una serie de retos, fundamentalmente debidos a la gran cantidad de genes que intervienen en la síntesis de los ácidos grasos. Destaca, por ejemplo, la necesidad de expresar coordinadamente estos genes que no son propios de las plantas sin afectar a su correcto crecimiento.
Hasta el momento se ha comprobado la posibilidad de producir EPA y DHA en organismos vegetales modelo como Arabidopsis thaliana (Ruiz-Lopez et al., 2013). Sin embargo, la producción de ácidos grasos omega 3 en grandes cantidades requiere del uso de plantas oleagionosas para que pueda llegar a ser verdaderamente rentable.
Se han realizado múltiples investigaciones con colza (Brassica napus) y camelina (Camelina sativa). En el caso de la camelina, se han producido versiones transgénicas capaces de producir DHA mediante la expresión de subconjuntos de genes que naturalmente se encuentran en microalgas. De hecho, se ha comprobado que el aceite obtenido a partir de estas plantas transgénicas no presenta efectos negativos sobre el crecimiento y la calidad nutricional de pescados de gran importancia comercial, como el salmón y la dorada (Betancor et al., 2015;Betancor et al., 2016).
En el caso de la colza, dos consorcios industriales (BASF & Cargill por un lado; Nuseed, CSIRO & GRDC, por el otro) han desarrollo cultivos transgénicos de forma exitosa. De hecho, en Estados Unidos la empresa australiana Nuseed tiene permiso para el cultivo de colza transgénica rica en omega 3 desde 2019, con la que se producen los suplementos Aquaterra, para la alimentación en piscifactorías, y Nutriterra, en alimentación humana (Nuseed). En Europa, sin embargo, las restricciones son mayores.
Conclusiones
El consumo de pescado y otros productos ricos en omega 3 esté adquiriendo un papel cada vez más importante en la dieta. Sin embargo, la principal fuente de estos ácidos grasos son los aceites de pescado, lo que conlleva un importante impacto ambiental. Esto ha derivado en la búsqueda de nuevas fuentes de omega 3 eficientes y sostenibles que, muy probablemente, serán parte del futuro de la alimentación humana.
Referencias
Aung, T., Halsey, J., Kromhout, D., Gerstein, H. C., Marchioli, R., Tavazzi, L., … & Clarke, R. (2018). Associations of omega-3 fatty acid supplement use with cardiovascular disease risks: meta-analysis of 10 trials involving 77 917 individuals. JAMA cardiology, 3(3), 225-233.
Betancor, M. B., Sprague, M., Usher, S., Sayanova, O., Campbell, P. J., Napier, J. A., & Tocher, D. R. (2015). A nutritionally-enhanced oil from transgenic Camelina sativa effectively replaces fish oil as a source of eicosapentaenoic acid for fish. Scientific reports, 5(1), 1-10.
Betancor, M. B., Sprague, M., Montero, D., Usher, S., Sayanova, O., Campbell, P. J., … & Tocher, D. R. (2016). Replacement of marine fish oil with de novo omega-3 oils from transgenic Camelina sativa in feeds for gilthead sea bream (Sparus aurata L.). Lipids, 51(10), 1171-1191.
EFSA (27 de julio de 2012). EFSA assesses safety of long-chain omega-3 fatty acids. European Food Safety Authority. https://www.efsa.europa.eu/en/press/news/120727
Miller, M. R., Nichols, P. D., & Carter, C. G. (2007). Replacement of fish oil with thraustochytrid Schizochytrium sp. L oil in Atlantic salmon parr (Salmo salar L) diets. Comparative biochemistry and physiology part A: Molecular & integrative physiology, 148(2), 382-392.
Nuseed (https://nuseed.com/omega-3-canola-program/)
Ruiz-Lopez, N., Haslam, R. P., Usher, S. L., Napier, J. A., & Sayanova, O. (2013). Reconstitution of EPA and DHA biosynthesis in Arabidopsis: iterative metabolic engineering for the synthesis of n− 3 LC-PUFAs in transgenic plants. Metabolic Engineering, 17, 30-41.
Shahidi, F., & Ambigaipalan, P. (2018). Omega-3 polyunsaturated fatty acids and their health benefits. Annual review of food science and technology, 9, 345-381.
Simopoulos, A. P. (2006). Evolutionary aspects of diet, the omega-6/omega-3 ratio and genetic variation: nutritional implications for chronic diseases. Biomedicine & pharmacotherapy, 60(9), 502-507.
Tocher, D. R. (2015). Omega-3 long-chain polyunsaturated fatty acids and aquaculture in perspective. Aquaculture, 449, 94-107.
Veramis (https://www.veramaris.com/home.html)
Wang, Y., Li, M., Filer, K., Xue, Y., Ai, Q., & Mai, K. (2017). Replacement of fish oil with a DHA‐rich Schizochytrium meal on growth performance, activities of digestive enzyme and fatty acid profile of Pacific white shrimp (Litopenaeus vannamei) larvae. Aquaculture Nutrition, 23(5), 1113-1120.
Xie, D., Jackson, E. N., & Zhu, Q. (2015). Sustainable source of omega-3 eicosapentaenoic acid from metabolically engineered Yarrowia lipolytica: from fundamental research to commercial production. Applied microbiology and biotechnology, 99(4), 1599-1610.