Una pregunta clave de la biología moderna ha sido el conocer cómo, desde la fecundación, con una sola célula podemos llegar a un ser humano completo. Es decir, cómo podemos pasar de una célula a millones de células diferentes que forman una serie de tejidos y órganos complejos con unas funciones muy definidas.
El descubrimiento de las células madre y las investigaciones derivadas del trabajo con ellas, a pesar de la controversia que han generado, nos han ayudado a resolver este y muchos otros enigmas. Hoy, con los problemas éticos abordados, siguen siendo unas aliadas imprescindibles en el estudio de muy diversas disciplinas.
Índice de contenido:
¿Qué son las células madre?
Si analizamos paso por paso lo que ocurre desde la fecundación veremos lo siguiente: partimos de una célula inicial que comienza a dividirse en células idénticas creando una esfera. Llegado un momento, las células que envuelven a la esfera empiezan a ser ligeramente distintas a las que están en el interior. Estas células están diferenciadas y tienen una morfología que varía en función de su localización. De esta forma, son las propias células las que escogen su destino: las que están en la parte exterior van a dar lugar a la placenta y las de la parte interior darán lugar a todos los demás tejidos del embrión.
A las células que están en la parte interior y que dan lugar a todos los distintos tejidos de un individuo es a las que llamamos Células Madre Pluripotentes Embrionarias.
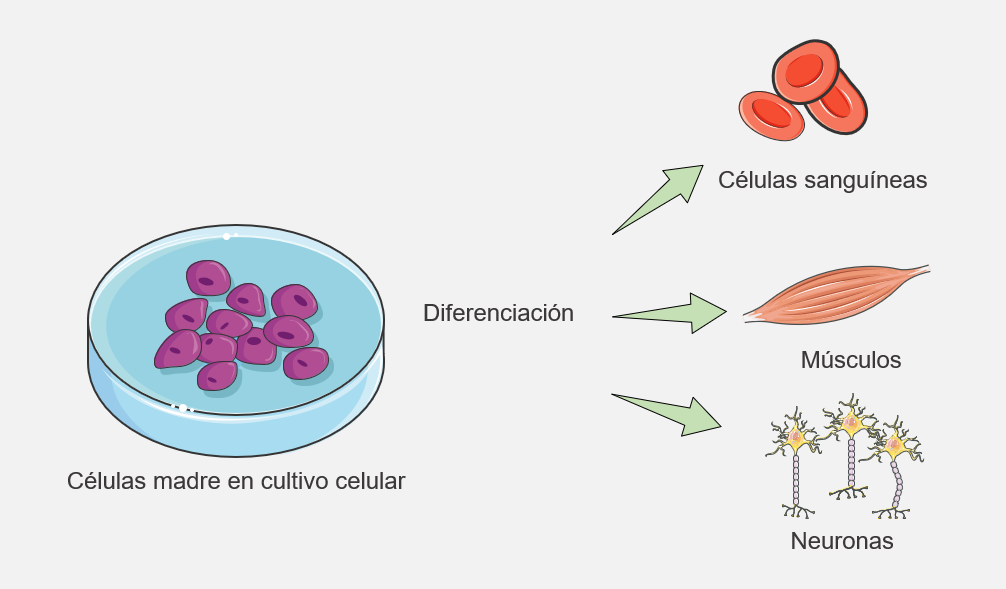
Esta característica, la pluripotencia, implica que estas células tendrán la capacidad de diferenciarse en cualquier tipo de tejido del organismo, desde neuronas hasta glóbulos rojos, pasando por células de la piel o del corazón. Además, tienen la capacidad de autorrenovarse, es decir, que pueden dividirse y dar descendencia idéntica un número ilimitado de veces.
El origen del estudio de las células madre
La primera vez que se consiguió aislar Células Madre Pluripotentes de ratón fue en 1981, de la mano de dos investigadores británicos llamados Martin Evans y Matthew Kaufman. Sin embargo, el conocimiento de estas células tiene unos orígenes muy distintos, ya que parte de estudios sobre un tipo de tumor muy raro conocido como teratocarcinoma en las décadas de 1950 y 1960.
Este tipo de tumores inquietaba mucho a la comunidad científica de la época porque, tratándose de un tumor maligno, tenía poblaciones de células que parecían de un embrión y otras poblaciones que parecían tipos celulares más maduros. Estudiando este tipo de tumores se llegó a la conclusión de que, si bien el mecanismo por el cual las células del tumor se diferenciaban dando lugar a otras células no era conocido, este podía ser análogo al de la formación de embriones, por lo que el estudio de este tipo de tumores debía ir de mano de la embriología.
A raíz de los estudios sobre teratocarcinomas, el pensamiento científico se dirigió a la idea de que tener células capaces de dar lugar a todos los tejidos podía ser muy interesante porque, potencialmente, podría permitir estudiar qué sucedía en todo el organismo. Sin embargo, había un problema con las células que se extraían de estos tumores y que se utilizaban en investigación, y era que la capacidad de convertirse en otros tipos celulares iba disminuyendo con el tiempo. Es decir, faltaba algo en esos cultivos celulares que hacía que no se dieran las condiciones adecuadas para mantener la pluripotencia de manera prolongada.
Con esto en mente y con la idea de que el estudio de estos tumores debía estar relacionado con la embriología, Martin Evans y Matthew Kaufman consiguieron aislar por primera vez un tipo de células que sí tenían las propiedades de pluripotencia y autorrenovación; células de la masa interna de un embrión de ratón. Esto fue un avance fundamental en el campo de la embriología y genética, porque permitió hacer multitud de estudios que permitieron conocer funciones específicas de distintos genes e incluso incorporar información genética en líneas celulares.
Siguiendo esta estela, el grupo de investigación dirigido por James Thomson, en el año 1998 consiguió cultivar células madre pluripotentes humanas, nuevamente, con las capacidades de diferenciación y autorrenovación.
Cómo inducir la pluripotencia
Como hemos dicho, las Células Madre Pluripotentes Embrionarias se obtienen de la masa celular interna de un embrión en cultivo. Es de sobra conocido que esto supone, para ciertos colectivos, un problema ético, lo que llevó a la comunidad científica a preguntarse si se podía inducir este estado de pluripotencia a células que no lo tuvieran. Esta inquietud se condensaba en una pregunta clave: el saber si la información se perdía cuando las células pasaban del estado de pluripotencia al estado diferenciado, o si, por el contrario, la información seguía ahí y se podía volver a ella.
La clonación
La forma de solucionar esta duda fue con la generación del primer animal clonado, que no fue la oveja Dolly, sino una rana de uñas africana (Xenopus laevis).

Fuente: http://creativecommons.org/licenses/by-sa/3.0/, Wikimedia Commons
El biólogo británico John Gurdon, que publicó sus resultados en 1962, para responder a la pregunta de si las células iban perdiendo la información sobre la pluripotencia, consiguió implantar una célula con información genética de una rana adulta en una rana hembra, de la cual nació un individuo genéticamente idéntico al original. Con esto se concretó que, efectivamente, la información genética necesaria para dar todos los tipos celulares se mantenía en el adulto y que debía de poderse llegar al estado de pluripotencia de alguna forma, por entonces, desconocida.
Ya en 1996, Keith Campbell e Ian Wilmut realizaron, ahora sí, la clonación del primer mamífero a partir de una célula adulta: Dolly. Desde ese momento comenzó en la comunidad científica mundial una carrera por intentar clonar el primer ser humano, aunque la implantación de esa célula con información genética de una persona adulta en una madre se prohibió por consideraciones éticas.
La era de la reprogramación
El objetivo fundamental de la clonación hoy en día no es el reproductivo, sino el de obtener un material celular a partir del cual poder obtener células madre de una persona en un contexto clínico, con sus características genéticas.
Para lograrlo, a lo largo de los años, se sucedieron una serie de estudios encaminados a conseguir células madre pluripotentes sin necesidad de utilizar embriones humanos. Algunos de ellos destacan por su gran trascendencia, como el de la científica Helen Blau en los años 1980, que demostró que, fusionando una célula pluripotente con una célula adulta, el ambiente de la pluripotente hacía que la adulta adquiriera características de pluripotencia.
Por fin, en 2006 Shin’ya Yamanaka y Kazutoshi Takahashi publicaron un hito histórico: partiendo de células de la piel de ratones adultos, habían sido capaces de reprogramarlas, es decir, de conseguir que se transformaran en células madre pluripotentes, con la potencialidad de convertirse a cualquier tipo celular.
Los estudios de Yamanaka lo habían llevado a demostrar la importancia de una serie de genes en el estado de pluripotencia de las células. Takahashi, un estudiante de doctorado del grupo de Yamanaka, logró introducir estos genes en células diferenciadas consiguiendo un estado de pluripotencia. Entonces, se dedicó a reducir la lista hasta quedarse con solo cuatro (que después se conocerían como los factores de Yamanaka) que eran los cuatro factores necesarios para que las células adultas volvieran a la pluripotencia. Las llamaron ‘Células Madre Pluripotentes Inducidas’ y le valió a Yamanaka el Nobel en 2012, junto a John Gurdon.
Células madre en investigación hoy
El descubrimiento de los factores de Yamanaka supuso una contribución inconmensurable en el estudio de la biomedicina. Sin la controversia ética que implicaba el uso de las Células Madre Pluripotentes Embrionarias, las Células Madre Pluripotentes Inducidas, y en concreto las de origen humano, han permitido transformar el campo de la investigación en medicina regenerativa y genética, con numerosos estudios en los que se utilizan estas células como modelos de enfermedad, plataformas de cribado farmacológico e incluso como potenciales terapias celulares.
Conclusión
16 años después del descubrimiento de los factores de Yamanaka aún no hemos llegado si quiera a extraer una parte del potencial que estas células tienen o de la información que nos pueden ofrecer. Lo que sí podemos anticipar es que, si el progreso de la investigación continúa, podremos llegar en un futuro cercano a replantearnos la medicina tal y como la conocemos.
Bibliografía
1. Evans, M. (2011). Discovering pluripotency: 30 years of mouse embryonic stem cells. Nature Reviews Molecular Cell Biology, 12 (10), 680-686.
2. Smith, A. (2010). Pluripotent stem cells: private obsession and public expectation. EMBO Molecular Medicine, 2 (4), 113-116.
3. Takahashi, K., & Yamanaka, S. (2006). Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell, 126 (4), 663-676.
4. Shi, Y., Inoue, H., Wu, J. C., & Yamanaka, S. (2017). Induced pluripotent stem cell technology: a decade of progress. Nature Reviews Drug Discovery, 16 (2), 115-130.