Además de carbono, hidrógeno, nitrógeno y oxígeno, los cuatro principales elementos químicos presentes en el organismo humano, existen otros minerales presentes en pequeñas cantidades pero claves para muchas funciones en el organismo: los oligoelementos. El cobre es el tercer oligoelemento en cantidad y es esencial para la función de numerosas enzimas, lo cual hace vital su presencia en las células humanas.
La enfermedad de Menkes, una enfermedad rara y letal, se caracteriza por la imposibilidad de distribuir correctamente el cobre entre los distintos órganos del cuerpo humano. La mayoría de los enfermos de Menkes no sobrepasan los 3 años y, a pesar de las numerosas investigaciones, no se conoce un tratamiento definitivo para revertir la enfermedad. Pero esto puede cambiar gracias al elesclomol, una molécula capaz de mejorar la distribución del cobre que ya se ha demostrado eficaz en ensayos preclínicos y en dos casos de niños enfermos.
Índice de contenido:
La mala distribución del cobre en el organismo, la causa de la enfermedad de Menkes
Una de cada 250.000 personas nacidas son enfermos de Menkes, lo que define este trastorno como una enfermedad rara por su baja incidencia. Aquellas personas que la padecen sufren como principales síntomas un gran daño neurodegenerativo, hipotonía muscular, hipotermia, flacidez, osteoporosis, convulsiones o cabello frágil y ensortijado. Todos estos síntomas son causados por la falta de cobre en ciertos órganos, ya que su insuficiencia hace que algunas enzimas dependientes de este elemento no realicen correctamente su función.
La enfermedad de Menkes es causada por la mutación del gen ATP7A que provoca la formación de una proteína disfuncional incapaz de excretar el cobre desde el el interior de las células al exterior. Esta mutación es adquirida por herencia ligada al cromosoma X. Es decir, la mutación pasa de generación en generación con la herencia del cromosoma X, del cual las mujeres poseen dos copias y los hombres solo una, por lo que una mutación en uno de los cromosomas X no será suficiente en las mujeres para causar la enfermedad (tendrán otra copia no mutada del gen) mientras que en los hombres causará la enfermedad.
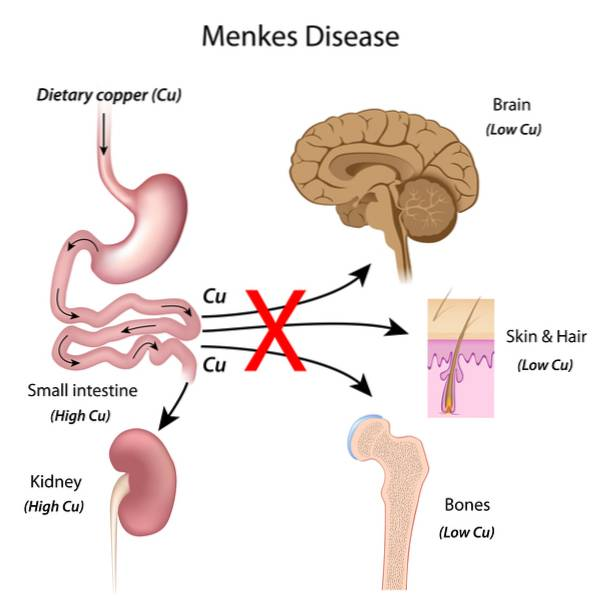
En la enfermedad de Menkes el cobre se encuentra en exceso en intestino delgado y riñones, sin embargo sus niveles son bajos en otros órganos como la piel o el cerebro. La falta de la proteína transportadora ATP7A provoca que el cobre se acumule en el interior de las células, aunque en el caso del cerebro, la falta de este transportador hace que el cobre no pueda ser adquirido por neuronas y células de la glía además de dificultar su paso a través de la barrera hematoencefálica. La escasez del elemento causa síntomas como el daño neurodegenerativo o las convulsiones comentados anteriormente.
Pero las mutaciones en el gen ATP7A pueden causar la producción de una proteína parcialmente funcional. Cuando este tipo de mutaciones se producen se habla de síndrome del cuerno occipital (OHS por sus siglas en inglés), que es en definitiva una forma menos agresiva de la enfermedad de Menkes. En este caso la afectación no es tan grave ya que la proteína producida puede ejercer parcialmente su función. Este síndrome se caracteriza por afectaciones óseas y del tejido conectivo principalmente.
Por otra parte, uno de los órganos no afectados en la enfermedad de Menkes es el hígado. Y es que en este órgano la proteína encargada de excretar al medio extracelular el cobre es la ATP7B en lugar de la ATP7A. Cuando esta otra proteína se ve afectada se produce la enfermedad de Wilson, normalmente diagnosticada en adultos y con un mejor pronóstico.
La mutación en el gen ATP7A y el metabolismo del cobre
¿Por qué la falta de cobre causa estos síntomas? ¿Cómo se distribuye el cobre en el organismo y qué funciones se ven afectadas por su escasez? El metabolismo del cobre en las células de nuestro organismo implica distintos factores que funcionan conjuntamente para asegurar su correcta distribución.
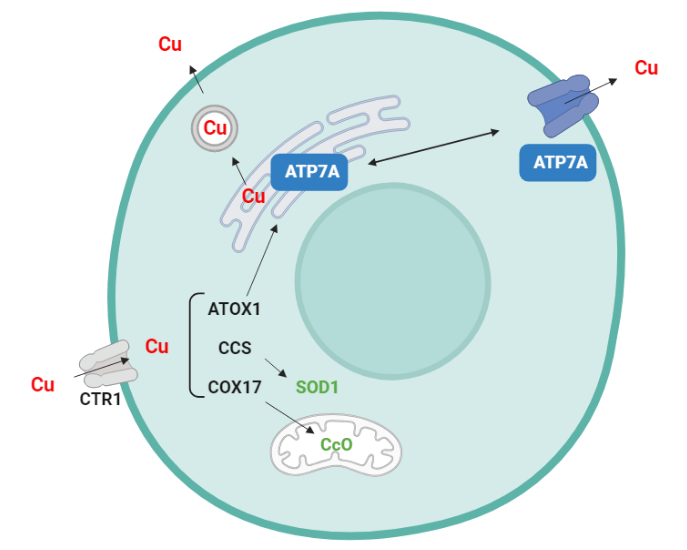
La entrada del cobre en las células se produce a través del transportador CTR1 y una vez en el citoplasma celular se une a metaloproteínas o glutatión. De esta forma se evita la presencia de cobre libre, que puede ser tóxico para la célula, y se almacena unido a proteínas. Cuando es necesario el cobre se une a tres chaperonas (ATOX1, CCS y COX17), encargadas de distribuir el cobre entre los distintos compartimentos celulares.
Así el cobre se mantiene en el citoplasma para activar la enzima superóxidodismutasa (SOD1), o es transportado a las mitocondrias donde se asocia con la enzima citocromo c oxidasa (CcO), o al aparato de Golgi donde se asocia con la proteína ATP7A. La unión con esta proteína guía al cobre para su asociación a enzimas presentes en el interior de la célula o para su salida al exterior y asociarse con enzimas de otras células o tejidos. El cobre es expulsado a través de vesículas, aunque cuando los niveles son altos la proteína ATP7A se mueve a la membrana plasmática para facilitar su expulsión.
Por tanto, cuando esta proteína ATP7A no puede ejercer su función, como en la enfermedad de Menkes, algunas enzimas no podrán activarse al no poder unir cobre. La falta de activación CcO afecta a la respiración celular y es la principal causa de síntomas de la enfermedad como el daño neurodegenerativo o la hipotonía muscular. La SOD se relaciona con la generación de radicales libres y su disfunción genera también daño neurodegenerativo.
Otras enzimas afectadas, como la lisil oxidasa, participan en la síntesis de colágeno o elastina, por lo que su mal funcionamiento se relacionará con síntomas como osteoporosis o piel frágil. Además, uno de los signos más reconocibles de la enfermedad, como es el pelo ensortijado y frágil, se relaciona con la disfunción por falta de cobre de la enzima sulfhidrilo oxidasa, relacionada con la síntesis de queratina, uno de los componentes de la estructura del cabello.
Terapias y tratamientos
Algunos lectores estarán pensando que la solución a esta enfermedad debe ser tan sencilla como la administración de cobre a los enfermos, dirigido a los órganos donde no llega en suficiente cantidad. Pero, y si os dijera que el cobre es tóxico en el organismo. ¿Cómo puede ser entonces que la falta de un elemento tóxico sea la causa de una enfermedad?
El cobre es tóxico sí, pero como he dicho antes, esta toxicidad se produce cuando se encuentra libre, no unido a proteínas. Por ello el cobre en nuestra sangre es transportado a los distintos órganos unido a ceruloplasmina, histidina o albúmina entre otras moléculas. Así, el tratamiento clásico de la enfermedad es la administración de histidinato de cobre, es decir, cobre unido a histidina formando un complejo, lo que hace que su poder tóxico sea mucho menor. A pesar de ello, la administración debe ser muy controlada ya que un exceso de cobre en el organismo implica efectos tóxicos más graves incluso que los propios síntomas de la enfermedad de Menkes.
Elesclomol, la nueva terapia esperanzadora
El histidinato de cobre comentado anteriormente no es más que un tratamiento paliativo, es decir, reduce los síntomas de la enfermedad, pero su mortalidad no se disminuye y la vida de los enfermos sigue siendo demasiado corta. Es por ello que los casos de Marco y Reda, en Barcelona y León respectivamente, han sido noticia en los últimos tiempos. Ellos han sido los primeros dos niños en el mundo tratados con elesclomol, incluso antes de que se hubieran producido ensayos clínicos para esta terapia.
El elesclomol es capaz de unir el cobre y guiarlo a la mitocondria, dotando a la enzima citocromo c oxidasa (CcO en el esquema) de cobre suficiente para realizar su función a pesar de la enfermedad, y reduciendo de esta forma el daño neurodegenerativo considerablemente. Estas evidencias se obtuvieron en 2020 en experimentos con ratones y se publicaron en la revista Science por investigadores de la Universidad de Texas.
Su uso en estos dos niños ha demostrado una gran mejora e incluso se ha conseguido un desarrollo neuronal normal en el caso de Marco, lo que ha dotado de grandes esperanzas a los enfermos de Menkes, y ha abierto la puerta a la realización de ensayos clínicos con esta molécula, dados sus buenos resultados en ratones y en estos dos casos aislados.
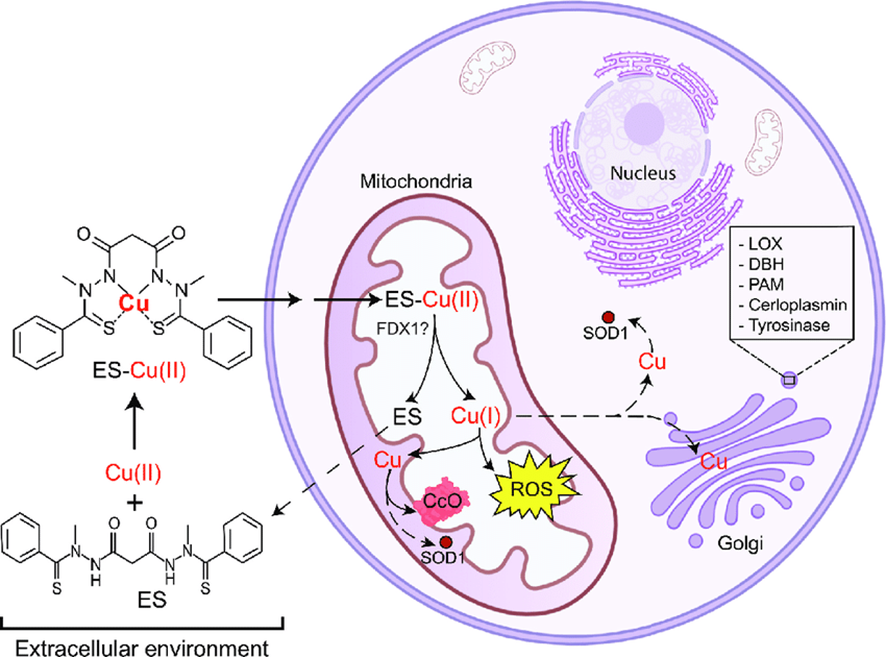
Estos ensayos clínicos pretenden comprobar la utilidad de la molécula frenando el daño neurodegenerativo en el cerebro de los enfermos. Es pronto para afirmarlo con certeza, pero tal y como se ha visto hasta ahora en ratones y en los tratamientos de Marco y Reda, tratar la enfermedad de Menkes de forma eficiente y mejorar la vida de los enfermos puede estar cada vez más cerca.
Conclusiones
La mala distribución de un elemento minoritario en nuestro organismo como el cobre causa una enfermedad tan grave como la enfermedad de Menkes, letal y que impide que los enfermos superen los 3 años. En este artículo hemos explicado cómo la falta o exceso de cobre causan síntomas y daños irreversibles en el cuerpo de los enfermos, lo que refleja la gran importancia del cobre para el funcionamiento de numerosos procesos en diferentes órganos.
Las grandes esperanzas puestas en el elesclomol por los buenos resultados que ha demostrado hasta ahora hacen que la enfermedad de Menkes pueda plantearse como una enfermedad menos letal en un futuro. Este gran avance debe esperar posiblemente unos años más para poder evaluar los ensayos clínicos y definir un tratamiento de primera línea para la enfermedad, lo que haría que niños y niñas como Marco y Reda mejoren considerablemente su calidad de vida y la de sus familias.
Artículo editado por Equipo de Microbacterium
Bibliografía
De Feyter, S; Beyens, A; Callewaert, B (2023). ATP7A-related copper transport disorders: A systematicreview and definition of the clinical subtypes. J Inherit Metab Dis. 46(2): 163-173. 10.1002/jimd.12590
Guthrie, L et al. (2020). Elesclomol alleviates Menkes pathology and mortality by escorting Cu to cuproenzymes in mice. Science. 368(6491): 620–625. doi:10.1126/science.aaz8899
Tumer, Z; Moller, L (2010). Menkes disease. European Journal of Human Genetics. 18: 511–518; doi:10.1038/ejhg.2009.187
Vishal M. Gohil (2021). Repurposing elesclomol, an investigational drug forthe treatment of copper metabolism disorders. Expert Opinion on Investigational Drugs. 30(1): 1-4. 10.1080/13543784.2021.1840550
Menkes disease (2023). Genetic and Rare Diseases Information Center (GARD). https://rarediseases.info.nih.gov/diseases/1521/menkes-disease
Menkes International Association(MIA) (2023). Aurora Mateos. https://menkesinternational.com/
A0A2R8YD60 · A0A2R8YD60_HUMAN. UniProt: the Universal Protein Knowledgebase in 2023. Nucleic Acids Res. 51:D523–D531 (2023)
ClinGen The Clinical Genome Resource. Heidi L. Rehm, Ph.D., Jonathan S. Berg, M.D., Ph.D., Lisa D. Brooks, Ph.D., Carlos D. Bustamante, Ph.D., James P. Evans, M.D., Ph.D., Melissa J. Landrum, Ph.D., David H. Ledbetter, Ph.D., Donna R. Maglott, Ph.D., Christa Lese Martin, Ph.D., Robert L. Nussbaum, M.D., Sharon E. Plon, M.D., Ph.D., Erin M. Ramos, Ph.D., Stephen T. Sherry, Ph.D., and Michael S. Watson, Ph.D., for ClinGen. N Engl J Med 2015; 372:2235-2242 June 4, 2015 DOI: 10.1056/NEJMsr1406261. https://search.clinicalgenome.org/kb/gene-validity/CGGV:assertion_9bc50734-316b-47db-ba10-61f3fde46cca-2018-02-07T170000.000Z?page=1&size=25&search=
Ana Soteras (2023). La mejoría de Marco abre la puerta a otros niños con la enfermedad de Menkes. The Objective. https://theobjective.com/sociedad/2023-02-27/mejoria-marco-puerta-ninos-enfermedad-menkes/




