¿Alguna vez te has parado a pensar en lo poco que te cuesta hacer pis? Tienes dos riñones trabajando tooooodo el día para ti, sin hacer ni un ruido, y no te has parado a pensar en la importancia que tiene que se mantengan sanos. Imagina que compras una maqueta de Lego a la que le falta una pieza. ¿A que ya no funciona igual? ¿A que ya no encaja igual? Pues eso es lo que pasa en el síndrome nefrótico de origen congénito. Venga, que vamos a verlo.
Bueno, antes de que podamos responder a tu pregunta sobre el síndrome nefrótico tenemos que repasar un poco la fisiología del riñón. Tal vez no te haga especial ilusión, pero es necesario para que puedas comprender la importancia de la terapia génica en el síndrome nefrótico por mutación en el gen NPHS2.
Índice de contenido:
La filtración glomerular
Seguro que te suena aquello de “los riñones filtran la sangre” pero ahora que ya eres mayor estás preparado para la verdad. No todo el riñón trabaja en filtrar la sangre, sino que contamos con unas estructuras especializadas en la filtración: los glomérulos. El resto de las estructuras renales participan en la formación de la orina que será posteriormente eliminada mediante procesos de secreción o reabsorción de moléculas, pero la verdadera filtración se produce en el glomérulo.
A continuación repasamos con más detalle la estructura del glomérulo para que puedas ser el próximo experto en filtración renal:
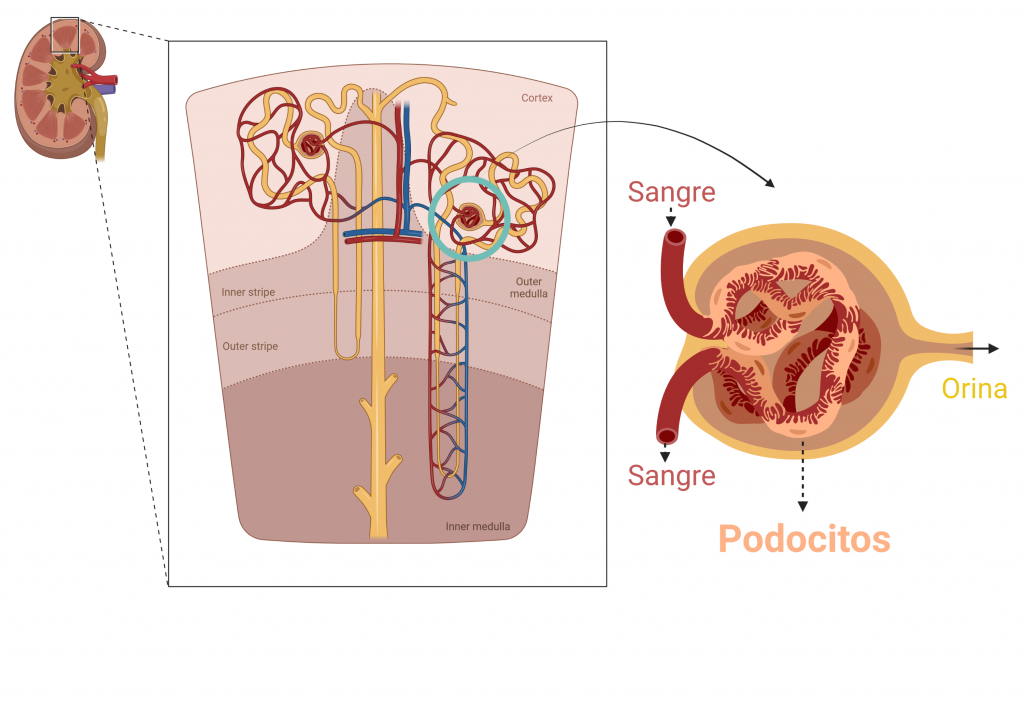
El glomérulo está formado por una red de capilares sanguíneos en forma de ovillo de lana. Por aquí circula la sangre que llega sucia del organismo (es decir, cargada de sustancias de desecho que necesitamos eliminar). Estas moléculas tienen que atravesar la barrera de filtración. Si hiciésemos un corte transversal del glomérulo podrías ver que ésta está compuesta por un capilar fenestrado (es decir, con ‘ventanas’ o poros por donde salen las moléculas de deshecho), una membrana basal glomerular que sirve de andamio y los podocitos (las células estrella de la barrera de filtración glomerular). Estos podocitos se llaman así porque son “células con pies”, es decir, emiten unas prolongaciones que interdigitan con las de los podocitos vecinos generando un filtro selectivo.
Ahora que ya conoces la estructura de glomérulo, si quieres puedes consultar este vídeo para hacerte una idea del proceso de formación de la orina.
Los podocitos no llegan a tocarse entre ellos de manera directa cuando están sanos, por lo que entre ellos quedan unos huecos (la denominada hendidura de filtración) por donde salen la moléculas de deshecho. Es por ello que a los podocitos no les queda más remedio que relacionarse entre ellos mediante las proteínas de la hendidura de filtración, por ejemplo: la podocina (codificada por el gen NPHS2) o la nefrina (codificada por el gen NPHS1), entre otras.
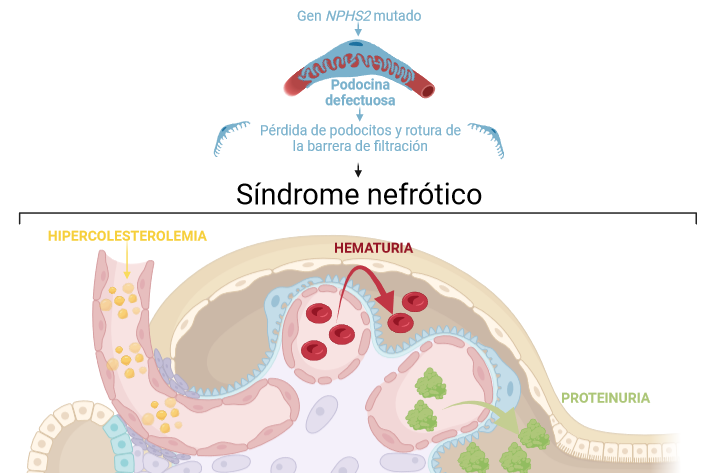
Si el anclaje del podocito a la membrana basal glomerular o las proteínas de la hendidura de filtración fallan, éste caerá a la orina, la barrera de filtración selectiva se romperá y se escaparán a la orina moléculas que deberían haber quedado retenidas en la sangre, como la albúmina (proteína sanguínea de transporte por excelencia) o células sanguíneas.
El síndrome nefrótico
¿Qué pasa si los genes que codifican las proteínas de la hendidura de filtración mutan? Que ese individuo tendrá unas proteínas defectuosas que no permiten que los podocitos establezcan entre ellos una hendidura de filtración sana, por lo que se caerán rápidamente. Muy rápidamente. Tanto como para conseguir inutilizar el riñón en la etapa infantil y requerir un trasplante.
Esta situación dará lugar a un síndrome nefrótico, es decir, a una alteración renal caracterizada por proteinuria (es decir, presencia de proteínas en orina), hematuria (sangre en orina), hiperalbuminemia (elevados niveles de albúmina en suero), hipercolesterolemia (elevados niveles de colesterol en sangre) así como edema (acumulación de líquidos en las extremidades).
El síndrome nefrótico congénito puede presentarse entre el nacimiento y los tres primeros meses de vida, mientras que el denominado síndrome nefrótico infantil puede aparecer entre los 3 meses y el año de vida. Ambos son raros defectos en la filtración glomerular que han sido heredados de los progenitores.
No es de extrañar, por tanto, que el síndrome nefrótico congénito suponga un riesgo para la vida y que sin un tratamiento agresivo presente una alta tasa de morbimortalidad. La mayoría de los casos presentan una buena respuesta al tratamiento con esteroides, pero alrededor de un 20-30% de los niños establecen un síndrome nefrótico resistente a esteroides, por lo que progresan rápidamente hacia el fallo renal. La buena noticia es que presentan una baja tasa de recurrencia de la enfermedad cuando reciben un trasplante de riñón.
Pueden deberse a mutaciones en distintos genes. El síndrome nefrótico congénito más frecuente es el de tipo finlandés, que afecta a más del 80% de los casos de síndrome nefrótico congénito detectado y que se produce por una mutación en el gen de la nefrina (NPHS1). Sin embargo, existen otros síndromes nefróticos que aparecen en el primer año de vida y que se producen por mutaciones en otros genes relacionados con los podocitos.
Hinkes et al han sugerido que dos tercios de los pacientes con síndrome nefrótico infantil pueden explicarse por mutaciones en genes como el gen PLCE1, WT1, LAMB2 o, en el caso que nos ocupa en este artículo, NPHS2 (o gen de la podocina). Ahora sabemos, además, que si la mutación se produce en un gen que codifica una proteína del podocito, el síndrome nefrótico será resistente a esteroides, lo que complica su pronóstico.
Cuando el gen que está mutado es NPHS2 (podocina), se genera un síndrome nefrótico autosómico recesivo (el paciente hereda dos copias defectuosas del gen de cada uno de sus progenitores) y resistente a esteroides. Las mutaciones en NPHS2 son responsables del 15% de los síndromes nefróticos congénitos detectados en la primera semana de vida. Hasta la fecha se han descrito 126 mutaciones distintas en el gen NPHS2: la más común de ellas impide que la podocina alcance su lugar de trabajo, la hendidura de filtración, y permanezca retenida en el orgánulo celular donde es sintetizada, el retículo endoplásmico.
La afectación de los pacientes es variable: las formas más agresivas cursan con proteinuria desde la infancia y necesitarán un trasplante hacia los 6 años de vida, mientras que otros pacientes pueden alcanzar la adolescencia con una proteinuria y unos síntomas más leves.
Habemus terapia
Te contaba todo esto para que veas lo importante que es disponer y desarrollar una terapia génica efectiva para aquellas enfermedades hereditarias que todavía hoy en día siguen sin un tratamiento realmente efectivo, como es el caso del síndrome nefrótico por mutación en el gen NPHS2.
Hasta ahora, la terapia mediante virus adenoasociados ha tenido resultados prometedores. Los virus adenoasociados son parvovirus pequeños, de unos 20 nm, que tienen una baja capacidad inmunogénica (nuestro sistema inmunitario no siente la necesidad de atacarlos y generar una reacción). Son ideales para infectar las células del paciente y vehiculizar allí los genes sin mutaciones, de tal manera que se pueda sintetizar la proteína correcta.
¿Que tus podocitos tienen mutado el gen NPHS2 y fabrican una podocina defectuosa? Empaquetamos dentro del virus adenoasoaciado un gen NPHS2 correcto, que infecte a los podocitos y les “enseñe” a fabricar una podocina en condiciones. Este mecanismo ya ha arrojado resultados prometedores en terapia génica contra la hemofilia o la atrofia muscular espinal, entre otras.
De momento, no podemos editar nuestros propios genes cuando nos diagnostican una enfermedad, pero podemos enviarles a las células la receta correcta. Este planteamiento sería efectivo (de momento) para aquellas patologías monogénicas, es decir, aquellas enfermedades que se producen por mutación en un solo gen.
Pues bien, hasta la semana pasada, los resultados para terapia génica en el riñón habían sido un fiasco. La semana pasada se publicó un nuevo estudio donde los autores han tratado podocitos humanos en cultivo y a ratones con una mutación en el gen NPHS2 (y que tienen, por tanto, un síndrome nefrótico resistente a esteroides) con virus adenoasociados que vehiculizaban una copia funcional del gen NPHS2.
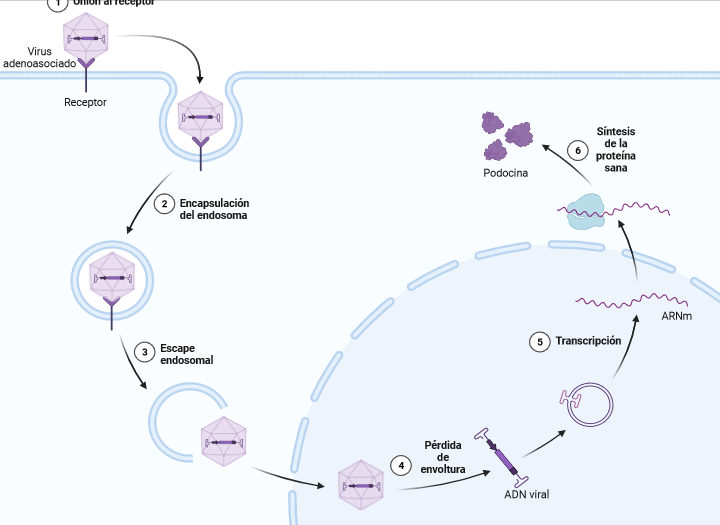
De esta forma, los autores han observado una mejoría en los ratones con el síndrome nefrótico: aumenta la supervivencia de los podocitos, mejora la estructura del podocito, disminuyen los glomérulos con fibrosis, se reduce los niveles de albúmina, urea y colesterol en la sangre, y disminuye la albuminuria. Todo ello se tradujo en un aumento de la supervivencia de los ratones.
Conclusión
Aunque todavía queda mucho camino por andar y por investigar en una terapia génica que permita curar el síndrome nefrótico por mutación en el gen NPHS2, este nuevo estudio muestra resultados prometedores mediante la utilización de virus adenoasociados. Esto permitiría mejorar la calidad de vida de las personas afectadas, fundamentalmente niños y adolescentes, y evitaría tener que recurrir a un trasplante de riñón.
Artículo editado por Equipo de Microbacterium
Bibliografía
Daehn, I. S., & Duffield, J. S. (2021). The glomerular filtration barrier: a structural target for novel kidney therapies. Nature reviews. Drug discovery, 20(10), 770–788. https://doi.org/10.1038/s41573-021-00242-0
Hinkes, B. G., Mucha, B., et al. (2007). Nephrotic syndrome in the first year of life: two thirds of cases are caused by mutations in 4 genes (NPHS1, NPHS2, WT1, and LAMB2). Pediatrics, 119(4), e907–e919. https://doi.org/10.1542/peds.2006-2164
AbuMaziad, A. S., Abusaleh, R., & Bhati, S. (2021). Congenital nephrotic syndrome. Journal of Perinatology, 41(12), 2704-2712.
Ding, W. Y., Kuzmuk, V., et al. (2023). Adeno-associated virus gene therapy prevents progression of kidney disease in genetic models of nephrotic syndrome. Science translational medicine, 15(708), eabc8226. https://doi.org/10.1126/scitranslmed.abc8226