Cada vez son más las mujeres que deciden retrasar la maternidad. Esta tendencia se ha incrementado especialmente en las últimas décadas, con una elevada fracción de la población española teniendo su primer hijo a partir de los 35 años. En esto la hormona AMH es muy importante.
En efecto, son muchos los motivos que empujan a posponer el embarazo; la precariedad laboral, la dificultad de emancipación o la desigualdad de género son de los más destacables. Es por ello por lo que, muchas mujeres, esperan hasta la década de los 30 (e incluso los 40) para tener descendencia. No obstante, para la mayoría de ellas, esta demora conllevará dificultades cuando decidan quedarse embarazadas, e incluso algunas se enfrentarán a la imposibilidad de conseguir gestación, viendo truncado su deseo de ser madres.
¿Habría alguna manera de anticiparnos a esta situación? ¿Existe algún indicador que, en cada caso, avise de la necesidad de preservar la fertilidad? La respuesta es sí y recibe el nombre de AMH.
Índice de contenido:
La reserva ovárica
Antes de adentrarnos a explicar el papel de esta hormona y cómo se relaciona con la fertilidad femenina, debemos entender el concepto de ‘reserva ovárica’.
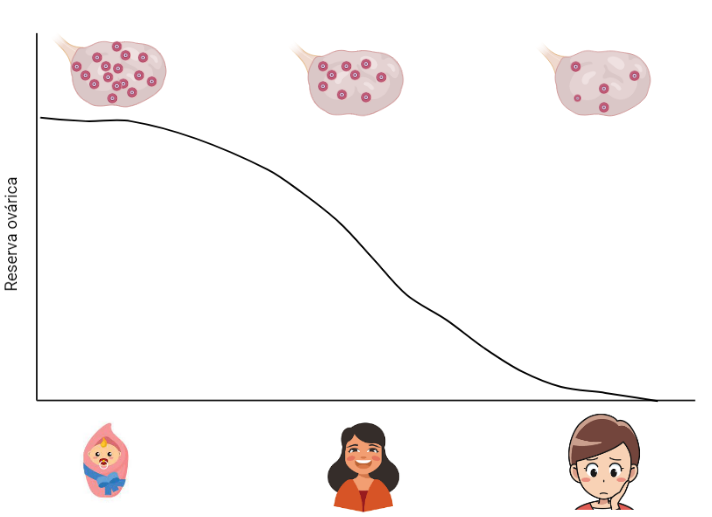
Todas las mujeres nacemos con un número determinado de ovocitos, que se sitúa en torno a un millón. A diferencia de lo que ocurre con los espermatozoides en el género masculino, estos ovocitos no se regeneran de forma continuada, sino que van disminuyendo con la edad hasta agotarse, momento que culmina con la menopausia y el fin de la edad fértil.
En cada ciclo menstrual, se produce la activación de unos 20 de estos ovocitos que, hasta entonces, se mantenían en reposo. De todos ellos solo uno llegará a ovularse, pudiendo ser en ese momento fecundado, mientras que el resto de ovocitos que se habían activado acabará degenerando.
Mediante este mecanismo de activación y degeneración, va disminuyendo la reserva ovárica de acuerdo a la edad de la mujer, pasando del millón de ovocitos disponibles en el nacimiento a unos 500.000 en la pubertad y a 300.000 hacia la década de los 30. Como puede observarse, antes de los primeros ciclos menstruales, ya se habrá perdido aproximadamente la mitad de los ovocitos de los que partimos al nacer, sólo por degeneración, sin siquiera haberse producido ovulación de ninguno de ellos.
Es a partir de los 35 años cuando el descenso en la reserva ovárica es más marcado, acelerándose hasta el agotamiento, alrededor de los 50 años. No obstante, hay situaciones en las que esto ocurre a una velocidad anormalmente elevada y se adelanta el final del periodo fértil. Es lo que se conoce como menopausia precoz o fallo ovárico precoz, y es la causa de los problemas de fertilidad que afrontan muchas mujeres al decidir postergar su maternidad.
La hormona antimulleriana (AMH) y su relación con la fertilidad
Como hemos comentado anteriormente, cada ciclo menstrual conlleva la activación y crecimiento de un conjunto de ovocitos (denominados folículos en sus primeras etapas de maduración). Alrededor de cada uno de estos folículos en crecimiento se sitúa una capa de células, las células de la granulosa, quienes serán las encargadas de producir la hormona protagonista de este artículo, la AMH.
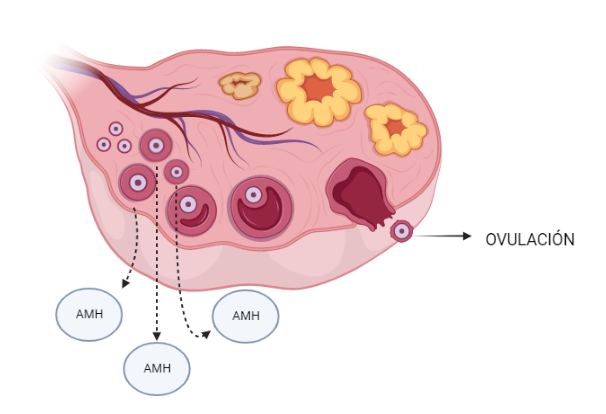
Esta hormona cumple importantes funciones en la regulación de la activación de los ovocitos y, al coincidir con el conjunto de folículos que se desarrollan en cada ciclo, también permite hacer una estimación de la reserva ovárica. En este sentido, a medida que aumenta la edad de la mujer, habrá menos folículos disponibles en el ovario, se activarán y desarrollarán menos ovocitos y, de esta forma, irá disminuyendo el nivel de AMH.
Hoy día, este es uno de los indicadores más fiables para determinar la reserva ovárica y, de esta forma, anticiparse a situaciones de menopausia precoz o, simplemente, de baja reserva. La medición de esta hormona se realiza en sangre y puede llevarse a cabo en cualquier día del ciclo, lo que, además, la convierte en una herramienta de gran utilidad en el campo de la reproducción humana.
Valores de AMH y significado clínico
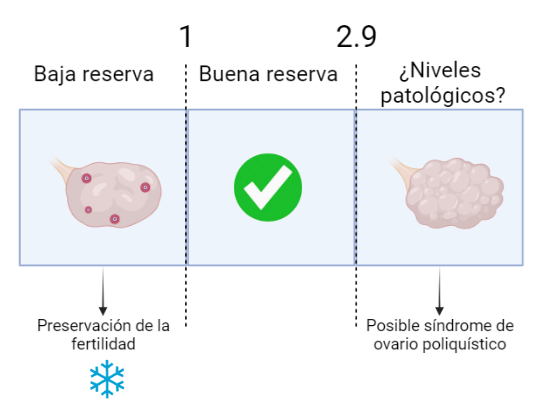
Unos niveles de AMH entre 1 y 2,9 ng/ml se consideran de buen pronóstico. Sin embargo, valores inferiores estarían advirtiendo de una reserva ovárica disminuida, situación en la que, si se pretende retrasar la maternidad, habría que plantearse opciones de ‘preservación de la fertilidad’.
Lo más usual sería optar por congelar óvulos, lo que se conoce como vitrificación ovocitaria. En este sentido, se podría hacer uso de estos ovocitos una vez se tomase la decisión de lograr el embarazo, sin tener que preocuparnos en exceso por la edad.
Por otro lado, niveles de AMH superiores a 3 ng/ml también pueden estar avisando de situaciones desfavorables. Por ejemplo, estos valores elevados de AMH se relacionan con patologías como el síndrome de ovario poliquístico, que también afecta a la fertilidad.
En el siguiente link, se puede acceder a una interpretación del valor de la AMH, que indica, basándose en estos niveles hormonales y la edad, el pronóstico de la reserva ovárica:
https://www.reproduccionasistida.org/calculadora-de-la-hormona-antimulleriana-amh/
Conclusiones
A pesar de que son muchos los aspectos que influyen en la fertilidad, conservar una adecuada reserva ovárica es uno de los principales a la hora de asegurar el embarazo.
Son numerosos los factores que pueden actuar disminuyendo el número de ovocitos disponibles a lo largo de la vida. Entre ellos, cabe destacar ciertos tratamientos médicos, como la quimioterapia, la exposición a tóxicos y contaminantes, la obesidad, los malos hábitos de vida, el estrés, etc.
Por ello, y por la libertad de decidir cuándo ser madres, es importante que se conozca y se promueva el uso de este marcador biológico que permita, por un lado, conocer nuestras posibilidades reproductivas y, por otro, actuar en aquellos casos en los que se advierta una reserva ovárica disminuida.
Referencias
Bentzen, J. G., Forman, J. L., Johannsen, T. H., Pinborg, A., Larsen, E. C., & Andersen, A. N. (2013). Ovarian antral follicle subclasses and anti-Müllerian hormone during normal reproductive aging. The journal of clinical endocrinology & metabolism, 98(4), 1602-1611.
Broer, S. L., Broekmans, F. J., Laven, J. S., & Fauser, B. C. (2014). Anti-Müllerian hormone: ovarian reserve testing and its potential clinical implications. Human reproduction update, 20(5), 688-701.
Dewailly, D., Andersen, C. Y., Balen, A., Broekmans, F., Dilaver, N., Fanchin, R., … & Anderson, R. A. (2014). The physiology and clinical utility of anti-Müllerian hormone in women. Human reproduction update, 20(3), 370-385.
Dolleman, M., Verschuren, W. M. M., Eijkemans, M. J. C., Dollé, M. E. T., Jansen, E. H. J. M., Broekmans, F. J. M., & Van der Schouw, Y. T. (2013). Reproductive and lifestyle determinants of anti-Müllerian hormone in a large population-based study. The Journal of Clinical Endocrinology & Metabolism, 98(5), 2106-2115.
Iwase, A., Osuka, S., Goto, M., Murase, T., Nakamura, T., Takikawa, S., & Kikkawa, F. (2018). Clinical application of serum anti‐Müllerian hormone as an ovarian reserve marker: A review of recent studies. Journal of Obstetrics and Gynaecology Research, 44(6), 998-1006.
Kristensen, S. L., Ramlau-Hansen, C. H., Andersen, C. Y., Ernst, E., Olsen, S. F., Bonde, J. P., … & Toft, G. (2012). The association between circulating levels of antimüllerian hormone and follicle number, androgens, and menstrual cycle characteristics in young women. Fertility and sterility, 97(3), 779-785.
Luke, B. (2017). Pregnancy and birth outcomes in couples with infertility with and without assisted reproductive technology: with an emphasis on US population-based studies. American journal of obstetrics and gynecology, 217(3), 270-281.
de Vet, A., Laven, J. S., de Jong, F. H., Themmen, A. P., & Fauser, B. C. (2002). Antimüllerian hormone serum levels: a putative marker for ovarian aging. Fertility and sterility, 77(2), 357-362.