¿Alguna vez te has preguntado cómo surgen las enfermedades genéticas? ¿Qué papel juegan en la genética clínica los fenómenos de reordenamiento genético? ¿Pueden estos causar las enfermedades genéticas per se o necesitan de otros factores para su aparición?
Si te interesa conocer las respuestas de estas preguntas, quédate a conocer más acerca de lo que es una translocación, uno de los fenómenos que tiene un gran impacto en el desarrollo de patologías genéticas. Su incidencia en la población humana es del 0,2%, por lo que es un suceso que no debe pasarse por alto. Conforme vayas avanzando en el artículo, verás que también es un problema en la reproducción asistida, ya que muchos casos de infertilidad vienen dados por la existencia de translocaciones en alguno de los progenitores.
Índice de contenido:
El fenómeno de translocación en genética clínica
Las translocaciones se definen como reordenaciones cromosómicas que suponen el desplazamiento de un segmento cromosómico a un nuevo destino en el genoma. Principalmente, surgen por roturas de cromosomas o por la incorrecta reunión de diferentes fragmentos cromosómicos.
Estos fenómenos genéticos fueron descubiertos entre finales de siglo XIX y principios del siglo XX, al ver cómo aparecían con gran frecuencia nuevos cromosomas en células cancerosas. Fue Theodor Boveri, un científico alemán, quien proporcionó las descripciones más detalladas de esta clase de células en esa época. Además, se lanzó a postular que esos cromosomas estimulaban el crecimiento del tumor y jugaban un papel esencial en el comportamiento maligno de las células cancerosas.
Hablemos a continuación de la clasificación de las translocaciones (Figura 1). Su clasificación se divide en intracromosómicas e intercromosómicas. Por su propio nombre, en las intracromosómicas, el intercambio genético ocurre en el mismo cromosoma mientras que, en las intercromosómicas, este ocurre entre distintos cromosomas. En esta última categoría, la translocación puede ser recíproca o no recíproca, en función de si el intercambio es mutuo o no.
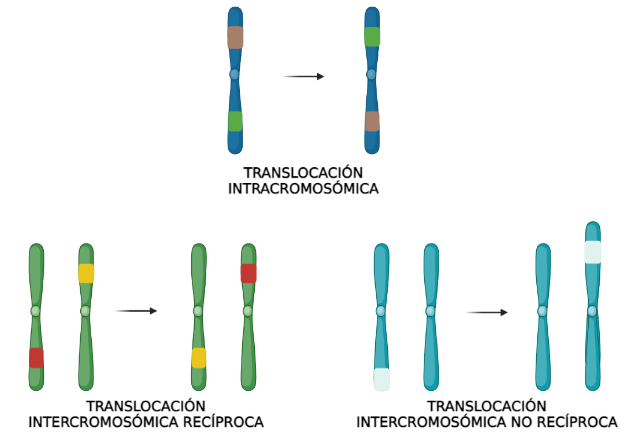
Ahora bien, te preguntarás qué repercusión o consecuencias tienen a nivel clínico. Las translocaciones pueden generar diferentes efectos a nivel celular, pero también a nivel sistémico. Por un lado, puede ocurrir lo que se conoce como efecto de posición, que implica una alteración en la regulación de los genes que se encuentran en las proximidades o dentro del segmento translocado. Por ejemplo, el linfoma de Burkitt surge de una translocación entre los cromosomas 8 y 14 que supone la transferencia del gen MYC al cromosoma 14. Este fenómeno provoca su activación; al estar involucrado en el crecimiento celular, la activación de MYC provoca el surgimiento de células B cancerosas.
Este suceso cromosómico también puede implicar la interrupción de genes y de su expresión, lo cual suele llevar a una deficiencia funcional de la proteína que codifica. Por último, si estas son graves, conducen a la formación de gametos inviables, al estar la información genética distribuida incorrectamente, produciendo infertilidad.
Vinculado con estas consecuencias, en este artículo trataremos más profundamente dos ejemplos de translocaciones que llevan a dos enfermedades de gran relevancia clínica: el síndrome de Down familiar y la leucemia mieloide crónica.
Síndrome de Down familiar
El síndrome de Down familiar surge por un reordenamiento del material cromosómico que lleva a que un tercer cromosoma 21 quede adherido a otro cromosoma (Figura 2). Por tanto, el individuo que lo padece alberga dos cromosomas 21 normales y un adicional que queda ligado al cromosoma 10, 13, 14, 15 o 22. Incluso en algunos casos puede ocurrir que dos cromosomas 21 se adhieran entre sí, llevando también al desarrollo de este síndrome.
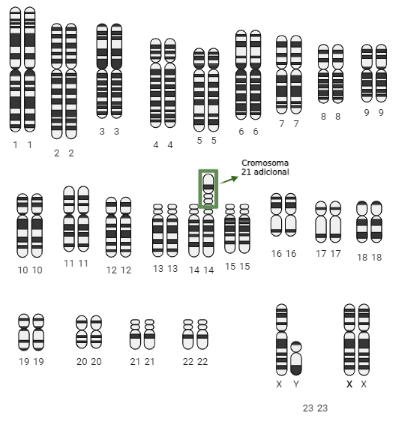
Siguiendo con el hilo de este síndrome, es clave destacar que es uno de los progenitores quien posee la translocación, que finalmente será heredada por la descendencia. Ahora bien, ¿por qué no se observan síntomas en alguno de los progenitores? Pues ocurre porque la información genética que presenta el portador de la translocación es la misma que la de un individuo sano, pero reordenada. A esto se le denomina translocación equilibrada. Sin embargo, esto puede suponer problemas de fertilidad o abortos espontáneos, puesto que heredar un exceso o un defecto de información genética normalmente supone la muerte del embrión o del feto. Como diría el refrán, «todo es bueno, pero en su justa medida».
Si tienes curiosidad por ver cómo se descubrió este tipo de síndrome de Down, te invito a que le eches un vistazo a este artículo.
Como curiosidad acerca del síndrome de Down, los niños que lo padecen presentan un mayor riesgo de sufrir leucemia, especialmente la leucemia megacarioblástica aguda (LMCA). Este tipo de cáncer es aproximadamente 500 veces más frecuente en pacientes de síndrome de Down comparado con el resto de población. Consiste en la adopción de un comportamiento maligno de las células precursoras de la línea mieloide (¡Aprende lo que son la línea mieloide y linfoide en inmunología aquí!).
Vinculado con este artículo, en 2020, unos investigadores en la ciudad de Copenhague descubrieron que una translocación entre los cromosomas 3 y 7 que incluía el gen CUX1 (Cut Like Homeobox 1) podría ser un promotor temprano del desarrollo de la LMCA. CUX1 actúa como un gen supresor de tumores que se localiza en el cromosoma 7. Por tanto, la mutación de CUX1, junto con la trisomía del 21, parece ser clave en las primeras fases de la LMCA. ¡Solo faltaría saber qué papel juega el exceso de información del cromosoma 21 en el origen de las leucemias!
Si quieres investigar más acerca del vínculo síndrome de Down-leucemia, te dejo este artículo, donde se coloca a GATA1 (GATA binding protein 1) como el principal gen que primeramente es mutado en el desarrollo de las leucemias mieloides.
Leucemia mieloide crónica
La leucemia mieloide crónica (LMC) es un cáncer en el cual se producen masivas divisiones de los glóbulos blancos de linaje mieloide. Esto conduce a la formación de coágulos en los vasos sanguíneos del paciente y al sangrado descontrolado, siendo una enfermedad fatal cuando todavía se desconocía su origen y desarrollo.
Sin embargo, en 1959, David A. Hungerford, en colaboración con Peter C. Nowell, detectó una anomalía en los cromosomas de las células sanguíneas de pacientes de LMC. La primera anomalía cromosómica asociada con el desarrollo de los primeros estadios de un cáncer se había descubierto, y se le denominó cromosoma filadelfia. Este hallazgo sentó una base en oncología para seguir investigando otros fenómenos cromosómicos que podrían conducir al desarrollo de otros linfomas y leucemias.
El cromosoma filadelfia (Figura 3A) surge de una translocación entre los cromosomas 9 y 22 provocando un alargamiento del primero y un acortamiento del segundo. Lo más destacable de este intercambio genético es que se produce una fusión de los genes BCR (B cell receptor) y ABL (Abelson protooncogene). Esto resulta en la formación continua de la proteína fusionada Abl, que controla la división celular de los glóbulos blancos (concretamente los linfocitos B).
Una vez identificada la principal causa que conduce a la LMC, la comunidad científica puede investigar con el fin de obtener un tratamiento contra este particular cáncer. Puesto que se produce la expresión continuada de esa proteína, se han desarrollado inhibidores (Figura 3B) que bloquean su acción. Ejemplo de ellos son los anticuerpos Imatinib y sus sucesores Dasatinib y Nilotinib, que esencialmente impiden la proliferación de las células cancerosas. A pesar de sus prometedores efectos, estas células consiguen sobrevivir al desarrollar resistencia a estos quimioterapéuticos.
De ahí surgen nuevas moléculas que tienen como diana el gen BCR-ABL, como las que se observan en este artículo (¡de muy alta complejidad!). Estas plantan cara a una mutación (T315I) que hace inefectivos a los anticuerpos mencionados anteriormente. Algunos ejemplos de estos nuevos inhibidores son PPY-A, que impide que la proteína haga su función de fosforilación (adición de un grupo fosforilo), y los inhibidores de las quinasas Aurora, unas proteínas que también fosforilan componentes celulares durante la división celular.

Por último y como mera curiosidad, la leucemia linfoblástica aguda (LLA) es otro tipo de cáncer que puede surgir tras la formación del cromosoma filadelfia. Sin embargo, ¡Se desconoce todavía más el transcurso de esta patología que el que de la LMC! En este caso, los linfocitos, otro tipo de glóbulos blancos (de linaje linfoide), son los afectados en esta batalla. En este artículo de elevada complejidad, publicado por Josep-María Ribera de la Universitat Autònoma de Barcelona en 2021, puedes descubrir los últimos hallazgos sobre la LLA.
Conclusión
El gran mensaje que debes llevarte a casa es que las translocaciones son fenómenos genéticos que pueden causar graves enfermedades: síndrome de Down, leucemias, linfomas… A día de hoy, no existe ningún procedimiento para revertir una translocación. Lo más parecido que podría ayudar a revertirlas sería la terapia génica, a partir de la cual se puede modificar deliberadamente el ADN de un paciente. Sin embargo, esto todavía no está legalizado y, de momento, sigue relegado al laboratorio. Y tú, ¿qué piensas? ¿Crees que algún día podremos revertirlas para eliminar la causa de estas enfermedades? Como dijo Severo Ochoa, «la ciencia siempre vale la pena, porque sus descubrimientos, tarde o temprano, siempre se aplican».
Artículo editado por Ricardo Hernández Cardeñas
Bibliografía
1. O’Connor, C. (2008) Human chromosome translocations and cancer. Nature Education 1(1):56
2. Casulo, C., & Friedberg, J. W. (2018). Burkitt lymphoma- a rare but challenging lymphoma. Best practice & research. Clinical haematology, 31(3), 279–284.
3. Síndrome de Down por Translocación (ucsd.edu)
4. Williams, J. D. et al. (1975). Familial Down syndrome due to t(10;21) translocation: evidence that the Down phenotype is related to trisomy of a specific segment of chromosome 21. American journal of human genetics, 27(4), 478–485.
5. Bache, I. et al. (2020). A shared somatic translocation involving CUX1 in monozygotic twins as an early driver of AMKL in Down syndrome. Blood cancer journal, 10(3), 27.
6. Garnett, C., Cruz Hernandez, D., & Vyas, P. (2020). GATA1 and cooperating mutations in myeloid leukaemia of Down syndrome. IUBMB life, 72(1), 119–130.
8. The Tale of the Philadelphia Chromosome | Au Science Magazine (ausm.org.uk)
9. Overview of the Philadelphia Chromosome (verywellhealth.com)
10. Schenone, S., Brullo, C., & Botta, M. (2010). New opportunities to treat the T315I-Bcr-Abl mutant in chronic myeloid leukaemia: tyrosine kinase inhibitors and molecules that act by alternative mechanisms. Current medicinal chemistry, 17(13), 1220–1245.
11. Liu, J. et al. (2021). Recent advances in Bcr-Abl tyrosine kinase inhibitors for overriding T315I mutation. Chemical biology & drug design, 97(3), 649–664.
12. Ribera J. M. (2021). Philadelphia chromosome-like acute lymphoblastic leukemia. Still a pending matter. Haematologica, 106(6), 1514–1516.
13. Muffly, L., & Kebriaei, P. (2020). Philadelphia chromosome positive acute lymphoblastic leukemia in adults: Therapeutic options and dilemmas in 2020. Seminars in hematology, 57(3), 137–141.




