¿Erradicar la malaria por completo? Parece un objetivo lejano y complicado pero lo cierto es que está más cerca de producirse de lo que creemos. Técnicas de edición genética como Gene Drive, destinadas a luchar contra el mosquito del género Anopheles transmisor de la malaria, llevan años en investigación y han despertado grandes esperanzas.
A pesar de los avances en la técnica Gene Drive, queda mucho trabajo por hacer tanto para mejorar la eficacia como la seguridad de la técnica, además de platearse desde un punto de vista ético si modificar el genoma de los mosquitos en nuestro beneficio y con las posibles complicaciones que puede conllevar es necesario para combatir la malaria.
Índice de contenido:
El repunte de malaria a nivel mundial
Tanto la incidencia como la mortalidad por malaria se habían conseguido reducir y la tendencia era a la baja hasta el año 2020. Sin embargo, desde este momento tanto el número de casos de la enfermedad como las muertes por malaria han experimentado un repunte y actualmente ambos datos aumentan cada año. Según las últimas cifras de la Organización Mundial de la Salud en 2021 se produjeron 247 millones de casos de malaria y 619.000 muertes en todo el mundo. Especialmente preocupantes son los datos en el continente africano, el más golpeado por esta enfermedad con un 95% de los casos y un 96% de las muertes.
Debido a este repunte mundial, nuevas herramientas para el control y el tratamiento de la malaria se han hecho necesarias, ya que con las utilizadas hasta ahora como los insecticidas, las redes mosquiteras, las vacunas o los fármacos preventivos no se está logrando frenar esta tendencia. Aquí es donde la edición genética, y más concretamente la técnica Gene Drive, se espera juegue un papel fundamental para controlar al vector transmisor y volver a conseguir una tendencia a la baja tanto de casos como de fallecimientos.
La técnica Gene Drive
La técnica Gene Drive consiste en el uso de elementos genéticos creados gracias a la herramienta de edición genética CRISPR-Cas, los cuales intervienen en la herencia del alelo seleccionado consiguiendo frecuencias supermendelianas de herencia y facilitando que este alelo se expanda en una población. Esta técnica está descrita más detalladamente en otro artículo de este blog redactado por TheBioaholic.

Existen dos perspectivas diferentes para implantar la herramienta. Por un lado, se han desarrollado sistemas que son capaces de, al ser insertados en una población de mosquitos Anopheles, suprimirla por completo llevándola al colapso, ya sea por infertilidad de los machos o por desaparición de las hembras de la población. El otro propósito es conseguir que los insectos sean incapaces de transmitir la enfermedad, al interferir en la relación entre mosquito y parásito. Tanto la supresión como la modificación de la población de mosquitos se postulan como probables para una futura aplicación.
Los primeros ensayos de campo
El uso de esta técnica está siendo especialmente comentado últimamente debido al repunte de malaria y los avances respecto a la modificación genética de mosquitos son cada vez más rápidos.
Gracias a este progreso, la OMS ha intervenido publicando una guía de criterios respecto a seguridad y eficacia para la realización de ensayos de campo con mosquitos transgénicos.
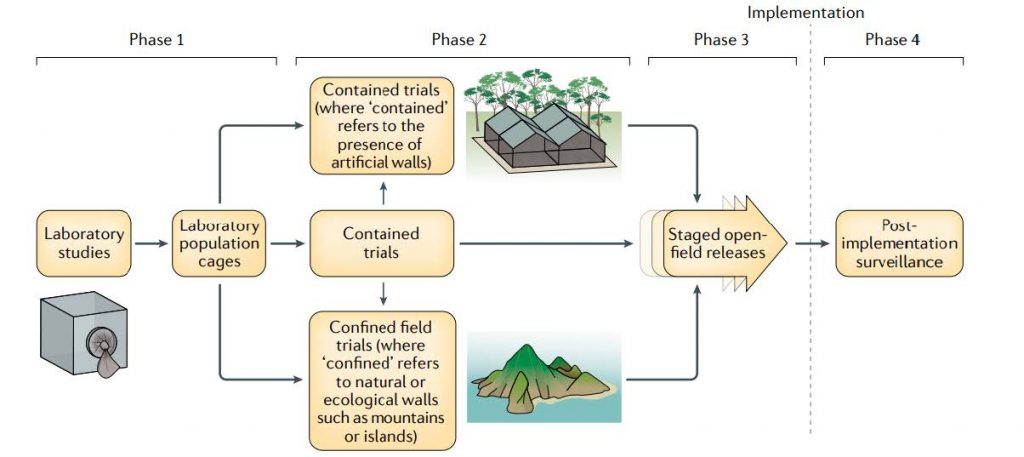
final según la última guía actualizada de la OMS. Adaptada de Bier E (2022). Gene drives gaining speed. Nature Reviews Genetics
Las fases para la realización de los ensayos de campo, como se refleja en el esquema, comienzan con estudios de laboratorio. Después se progresa a una segunda fase de ensayos confinados (artificialmente o naturalmente, por ejemplo en islas aisladas). La tercera fase consiste en ensayos a campo abierto a pequeña escala o para la implantación final. Por último la OMS define como cuarta fase investigaciones posteriores a la implantación para asegurar su seguridad y eficacia.
Actualmente, la máxima fase alcanzada ha sido la fase 2, mediante jaulas o insectarios o mediante el uso de sistemas self-limiting. Es decir, sistemas que introducen la modificación genética en la población pero que están diseñados para que esta tras unas cuantas generaciones sin dejar rastro.
Estos ensayos controlados se han producido ya en zonas de África. Este es el caso del ensayo producido en Bana (Burkina Faso), con un sistema gene drive self-limiting desarrollado en colaboración entre grupos de investigación del Imperial College de Londres y grupos de investigación del Instituto de Investigación en Ciencias de la Salud de Burkina Faso. A través del sistema mark-release-recapture mediante el cual volvieran a capturar mosquitos en las zonas donde se liberaron, se pudo comprobar la desaparición del transgén tras 7 meses.
Este tipo de sistemas han sido de gran utilidad para poder dotar de una gran seguridad a los ensayos intermedios antes de la aplicación total de la herramienta con un sistema que se mantenga en la población o self-sustaining. A pesar de ello, más pruebas y ensayos deben ir realizándose para avanzar a la fase 3.
¿Qué problemas y peligros puede conllevar?
Uno de los principales obstáculos del empleo de organismos modificados genéticamente como herramienta para frenar la malaria tiene que ver con problemas que estas modificaciones pueden causar en el ecosistema donde se liberen.
En primer lugar, el uso de estos organismos provocaría un cambio en el ecosistema. Este cambio que se busca sería beneficioso para conseguir erradicar la malaria, pero podría acarrear consecuencias negativas. Podrían producirse tanto problemas en el agua del ecosistema, hábitat donde los mosquitos Anopheles son clave para el mantenimiento de la biodervisad, como problemas por la supresión de la especie o por modificación de su comportamiento.
Suprimiendo una especie de mosquitos, objetivo pretendido por algunos sistemas gene drive, se estaría suprimiendo una especie polinizadora y una fuente de alimento para ciertos predadores, campos sobre los cuales es necesario seguir trabajando para obtener más información acerca de las posibles consecuencias.
La inclusión de organismos modificados genéticamente en un ecosistema puede acarrear que la modificación que estos portan fluyan hacia otras especies, lo que se conoce como gene flow o flujo genético. En este caso, los estudios realizados entre especies del género Anopheles han desvelado que es probable el flujo entre especies de este género pero el flujo horizontal hacia otros géneros se antoja más complicado. Estas consecuencias de flujo genético se han destacado entre los grandes expertos como uno de los aspectos que más se debe estudiar y tener en cuenta a la hora de desarrollar un sistema gene drive.
Bioética y colonialismo
Además de todos estos problemas que hacen referencia a la biodiversidad del ecosistema y a las consecuencias genéticas de la aplicación de los sistemas gene drive, existen problemas bioéticos claves también para la aplicación final.
Debemos plantearnos si modificar organismos y utilizarlos en el ecosistema, editando a la carta la naturaleza a nuestro favor, es ético y necesario. Es decir, si realmente la erradicación de una enfermedad con esta gran mortalidad es motivo suficiente para modificar nuestro entorno de manera irremediable. ¿Tiene el ser humano la potestad para manejar la naturaleza a su antojo, a pesar de que sea con fines beneficiosos como la erradicación de la malaria?
Por otra parte, muchos investigadores y expertos en el tema han destacado la importancia de incluir en la decisión de aplicar o no este tipo de sistemas a la población local de la zona que pueda verse afectada por consecuencias perjudiciales. En este caso estas poblaciones son mayoritariamente africanas, ya que la afectación por malaria en estas zonas son mayores. Desde hace ya un tiempo se habla de tratar de hacer partícipes a los habitantes de las zonas afectadas activamente en el proceso de aplicación del gene drive.
La mayoría de investigaciones para el desarrollo de este tipo de técnicas se producen en Europa y Estados Unidos. Desde el punto de vista de la población local se podría interpretar esto como una forma de acción colonial sobre los países africanos, en lugar de como una potente herramienta contra la malaria beneficiosa para la salud mundial.
Por ello, y para tratar de lograr aceptación para la realización de ensayos y pruebas, se ha pretendido incluir dentro de los proyectos a investigadores locales, y se han mantenido contactos constantes con las autoridades y organizaciones locales, tratando de divulgar acerca de los beneficiosos y explicar también los peligros. De esta forma se confiere a la población un conocimiento y unas nociones acerca de la herramienta que permite tomar una decisión.
Un ejemplo de esta conciliación entre investigadores y gestores locales y grupos extranjeros desarrolladores de los sistemas está representado por la fundación TargetMalaria, que además de laboratorios en Europa y Estados Unidos, posee sedes en países como Burkina Faso o Uganda, las cuales están integradas mayoritariamente por científicos locales.

Conclusión
El tiempo y el transcurso de las investigaciones dirá si la implantación total de los sistemas gene drive se acaba produciendo. Es necesario llegar a un buen nivel de equilibrio entre eficacia y seguridad y, para ello, se deben seguir estudiando sistemas y proponiendo ensayos de campo que permiten conocer más a fondo los posibles efectos, beneficiosos y perjudiciales, que el gene drive puede traer consigo.
De todas formas, alterar genéticamente organismos y por tanto ecosistemas trae consigo una gran controversia, por lo que el uso de este tipo de técnicas se sigue posponiendo en el tiempo. ¿Viviremos algún día la erradicación de la malaria gracias a este tipo de técnicas?
¿Crees que la genética puede ser tu área de interés? Desde STEM Future Education ofrecen progamas formativos para la industria científica como el Máster en Genética, Genómica y Biología Celular, un máster que te da la oportunidad de formarte en disciplinas con un futuro muy prometedor.
Artículo editado por Equipo de Microbacterium
Bibliografía
- World Health Organization (WHO) [Internet]. Geneva (Switzerland): WHO; 2022. World Malaria Report 2022. Disponible en: https://www.who.int/teams/global-malaria-programme/reports/world-malaria-report-2022
- World Health Organization (WHO) [Internet]. Ginebra (Switzerland): WHO; 2021. Guidance framework for testing genetically modified mosquitoes, second edition. Disponible en: https://www.who.int/publications/i/item/9789240025233
- Nolan T. Control of malaria-transmitting mosquitoes using gene drives. Philosophical Transactions Royal Society B. 2021; 376: 1-6.
- Bier E. Gene drives gaining speed. Nature Reviews Genetics. 2022; 23: 5-22.
- Target Malaria [Internet]. Target Malaria. A vector control research alliance, 2022. Disponible en: https://targetmalaria.org/
- Yao F, Millogo A, Epopa P, North A, Noulin F, Dao K, Drabo M, Guissou C, Kekele S, Namountougou M, Ouedraogo R, Pare L, Barry N, Sanou R, Wandaogo H, Dabire R, McKemey A, Tripet F, Diabaté A. Mark-release-recapture experiment in Burkina Faso demonstrates reduced fitness and dispersal of genetically-modified sterile malaria mosquitoes. Nature Communications. 2022; 13 (1): 796-807.
- Kyrou K, Hammond A, Galizi R, Kranjc N, Burt A, Beaghton AK, Nolan T, Crisanti A. A CRISPR-Cas9 gene drive targeting doublesex causes complete population suppression in caged Anopheles gambiae mosquitoes. Nature Biotechnology. 2018; 36 (11): 1062-1066.
- Garrood WT, Cuber P, Willis K, Bernardini F, Page NM andHaghighat-Khah RE (2022), Driving down malaria transmission with engineered gene drives.Front.Genet.13:891218.doi: 10.3389/fgene.2022.891218




