A pesar de que el ser humano es el organismo más complejo y evolucionado de la Tierra, el tamaño de nuestro genoma no es especialmente grande. ¡Es incluso menor que el de algunos peces y amebas! La razón de su complejidad no radica en el tamaño, sino en los mecanismos de regulación genética o mecanismos epigenéticos que llevan a que se activen o no la expresión de ciertos genes. Uno de estos «interruptores del genoma» se denomina epigenética. ¿Quieres saber en qué consiste este mecanismo y qué implicaciones tiene? ¡Te lo explico a continuación!
Índice de contenido:
Algunos conceptos básicos
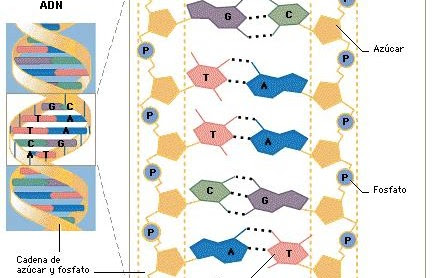
El genoma o material genético de un organismo está formado por el conjunto completo de su ADN presente en cada una de sus células y contiene toda la información necesaria para su crecimiento y desarrollo. La molécula de ADN (o ácido desoxirribonucleico) es una doble cadena en forma de hélice compuesta de millones de repeticiones de unas unidades llamadas nucleótidos. Cada nucleótido está formado por un grupo fosfato (PO4–), una pentosa (monosacárido de cinco unidades de carbono) y una base nitrogenada (adenina, timina, guanina o citocina). Cada nucleótido se nombra según la base que lo forma, a saber, adenina (A), timina (T), guanina (G) y citosina (C).
Esta doble hélice de ADN está formada por cadenas complementarias en las que la adenina (A) de una cadena se aparea con la timina (T) de la otra mediante dos enlaces de hidrógeno y la citocina (C) con la guanina (G) mediante tres enlaces. La unidad del ADN se mide en pares de bases (un nucleótido enfrentado a su complementario) y el genoma humano posee un tamaño aproximado de unos 3000 millones de pares de bases, lo que representa un tamaño medio entre los organismos cuyo genoma es conocido.
Sin embargo, no todos estos 3000 millones de pares de bases se corresponde con genes, definidos como ‘fragmentos de ADN que contienen la información genética para producir una proteína’ siguiendo el dogma central de la biología (el ADN se transcribe a ARN y este se traduce a proteínas). Se calcula que aproximadamente solo un 2% de estas 3000 millones de pares de bases corresponden a genes (unos 20000 genes aproximadamente), mientras que el 98% restante se agrupa en ADN regulador, fragmentos repetitivos, fragmentos móviles del genoma o fragmento que se transcriben a ARN pero no se traducen a proteínas.
¿Cómo se organiza el genoma dentro del núcleo?
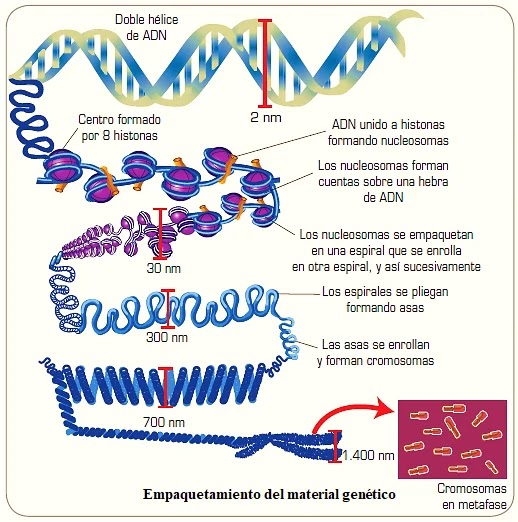
El núcleo celular es un orgánulo membranoso que se encuentra aproximadamente en el centro de la célula eucariota. Normalmente, existe un núcleo por célula, aunque algunas poseen más de uno, y una de sus funciones es la de proteger todo este material genético en su interior. Sin embargo, el tamaño promedio del núcleo es de 6 micrómetros, mientras que la longitud del ADN nuclear es aproximadamente de 2 metros, por lo que debe empaquetarse para caber dentro.
Para poder llevar a cabo este empaquetamiento, el ADN, que posee carga negativa por la presencia de los grupos fosfato (PO4–), se asocia con proteínas de carga positiva llamadas histonas a intervalos más o menos regulares. El primer nivel de empaquetamiento de la doble hélice se realiza con ocho de estas proteínas para formar unas estructuras llamadas nucleosomas. Posteriormente, esta estructura continua enrollándose y empaquetándose aún más con otras proteínas hasta formar los cromosomas, que son visibles al microscopio durante el período de división celular.
Sin embargo, para que un gen pueda expresarse en proteínas, la hebra de ADN debe ser accesible a otras proteínas, llamadas factores de transcripción. Estas son las que inician y ayudan a que el ADN pueda transcribirse y para ello la cromatina debe desempaquetarse. De esta manera, una célula puede regular qué genes son accesibles, y por tanto se expresan, en un determinado momento. Existen muchos mecanismos epigenéticos para ejercer esta regulación y algunos de ellos están bajo la influencia de factores ambientales, sirviendo así de conexión entre ambiente y genes.
Epigenética, el interruptor del genoma
Uno de estos mecanismos epigenéticos de regulación de la expresión genética es conocido como epigenética (‘por encima de’ del prefijo griego -epi). El término fue acuñado por el biólogo Conrad Waddington en 1939, quien la definió como ‘el estudio de todos los eventos que llevan al desenvolvimiento del programa genético del desarrollo’ o ‘el complejo proceso de desarrollo que media entre genotipo (factores genéticos) y fenotipo (factores ambientales)’.
Antes del surgimiento de la epigenética se consideraba que los genes describían todo el comportamiento y el fenotipo humano. Actualmente, se reconoce el papel fundamental que el ambiente extranuclear, extracelular y social ejerce en la modulación de la actividad genética, de manera que los genes ya no son sólo factores estáticos, sino factores dinámicos que son activados y silenciados según las circunstancias.
Más tarde, fue el biólogo molecular Robert Holliday quien propuso que el silenciamiento de los genes se producía por la adición de unos grupos químicos al ADN llamados grupos metilo (-CH3) y que la epigenética podría tener un posible rol en la herencia y desarrollo de algunas enfermedades.
Actualmente se define como epigenética al estudio de los cambios en la función de los genes que son heredables en la descendencia, que no entrañan una modificación en la secuencia del ADN (serían mutaciones) y que son reversibles.
Mecanismos epigenéticos
Se han descrito tres mecanismos epigenéticos que controlan la expresión de los genes a nivel molecular, que explicaré a continuación.
Uno de los primeros mecanismos epigenéticos descubiertos y más estudiados es la metilación en los pares de nucleótidos guanina-citosina en el ADN. Este proceso de metilación se produce fundamentalmente en la división celular para disminuir la expresión de ciertos genes, permitiendo evolucionar hacía uno u otro tipo celular. Uno de los ejemplo más sorprendentes es el que ocurre con uno de los cromosomas X (o todos menos uno) en las hembras de algunas especies de mamíferos. Debido a que los individuos de sexo femenino tienen dos cromosomas X (con sus genes correspondientes), uno de ellos debe permanecer sin expresión, porque sino tendrían más genes que el macho de su especie. Esto se consigue mediante la metilación y silenciamiento de los genes de uno de los dos cromosomas.
El segundo mecanismo epigenético es la modificación química de las histonas de la cromatina, como la acetilación o la metilación. Estas modificaciones permiten cambiar la carga eléctrica positiva de las histonas en su interacción con el ADN (de carga eléctrica negativa), de manera que les sumen más cargas positivas (en el caso de la metilación) o negativas (en la acetilación). En la acetilación al sumarle cargas negativas a las histonas, permite que estas se ‘aflojen’ en su interacción con el ADN y resulte más accesible a los factores de transcripción, facilitando este proceso, y por tanto, la activación génica. En la metilación se da el proceso inverso, favoreciendo el empaquetamiento del ADN y resultando en el silenciamiento de los genes.
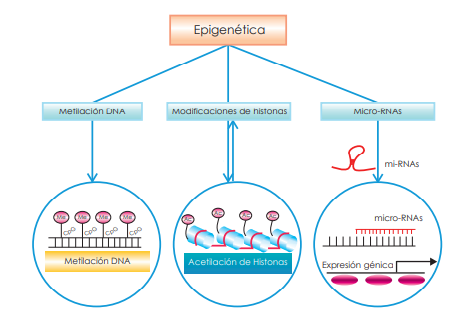
Un tercer mecanismo relacionado con los procesos epigenéticos es el de los micro ARNs. Estos son pequeñas moléculas de ARNs de cadena simple y que tienen la capacidad de regular la expresión de otros genes. Esto lo consiguen uniéndose a pequeñas regiones del ARN mensajero (producto de la transcripción del ADN) e inhibiendo su traducción a proteínas. De esta forma, aunque los micro ARN no actúan directamente sobre el ADN, funcionan en estrecha relación con la metilación del ADN y las modificaciones de la cromatina.
Implicaciones de los mecanismos epigéneticos
Los mecanismos epigenéticos tienen gran influencia sobre diversas enfermedades que afectan a la especie humana. Algunas de estas enfermedades son:
Cáncer
Conocer que los mecanismos epigenéticos estaban implicados en la producción de ciertos tipos de cáncer (el mejor conocido es el colorrectal) ha supuesto un cambio drástico en el manera de entender la enfermedad. Está bien establecido que estas alteraciones aparecen en estadios precoces del cáncer, sin necesidad de mutaciones previas a su desarrollo, aunque tampoco es incompatible la existencia de ambos eventos simultáneamente.
Entre las diversas alteraciones epigenéticas que comportan una expresión génica alterada, la metilación está considerada por muchos autores como el principal mecanismo epigenómico implicado en el cáncer. Las consecuencias de estos mecanismos epigenéticos incluyen la alteración de la transcripción del ADN, la activación aberrante de determinados genes la predisposición a la inestabilidad génica– y el silenciamiento de genes que detienen el inicio y progresión de los tumores.
Existen algunas técnicas de laboratorio, como la PCR, capaces de detectar patrones de metilación en el genoma. Esto es especialmente importante ya que existen algunas terapias epigenéticas desarrolladas o en desarrollo, cuyo objetivo es revertir el silenciamiento génico provocado por el exceso de metilación. Estas terapias van dirigidas al bloqueo de las enzimas encargadas del proceso de metilación, llamadas ADN metiltransferasas. Un ejemplo de medicamentos inhibidores de estas enzimas (llamado 5-azacitidina) se usa actualmente para el tratamiento de los síndromes mielodisplásicos.
Enfermedades metabólicas
Recientemente se ha observado la influencia del medio ambiente fetal en enfermedades metabólicas del adulto, como son la obesidad o la diabetes mellitus tipo 2 (DMT2). Así, se ha visto que los hijos de madres con diabetes gestacional son más propensos a desarrollar problemas como obesidad, diabetes, hiperlipidemia (exceso de lípidos en sangre) o hipertensión durante la vida adulta.
La malnutrición materna durante la gestación se ha relacionado con una restricción del crecimiento intrauterino (RCIU), es decir, que el feto no logra alcanzar todo su potencial de crecimiento y su peso estimado por ecografía está por debajo del percentil diez para su correspondiente edad gestacional. Además, según la hipótesis Barker (por el nombre del autor que la propuso), este RCIU está asociado con enfermedades del adulto.
En su estudio, Barker y otros autores observaron que individuos nacidos en Herfordshire (Inglaterra) durante el difícil período entre 1911 y 1930 tuvieron bajo peso al nacer y al año de edad, y presentaron un riesgo aumentado de muerte por enfermedad cardiovascular y accidente cerebrovascular de adultos. Otros estudios epidemiológicos similares en individuos nacidos en Países Bajos durante una hambruna (1944 – 1945) revelaron que la malnutrición materna estaba asociada con reducción en el peso al nacer y con aumento en la incidencia de obesidad, resistencia a la insulina, hipertensión y enfermedad arterial coronaria en el adulto.
Los mecanismos epigenéticos detrás de estos procesos parecen ser los patrones de metilación y acetilación de histonas que se generan durante el desarrollo fetal. Por ejemplo, se ha visto que un menor aporte de sustancias capaces de transferir grupos metilo, como el ácido fólico o la metionina (aminoácido esencial), en embarazadas conlleva una disminución de la metilación de ciertos genes en el ADN fetal. Otras sustancias que interfieren con el grado de metilación son el selenio, el bisfenol A, el tocoferol (vitamina E) o el disulfuro dialílico (compuesto presente en los ajos). Es importante conocer todos estos factores para poder prevenir futuros problemas en el adulto.
Conclusión
La idea histórica de que nuestro genoma es una información estática e inamovible ya es cosa del pasado. Actualmente, se sabe que existen muchísimos mecanismos epigenéticos de regulación que hacen que nuestro material genético sea dinámico, activándose y silenciándose según los factores externos que nos rodean.
Sin embargo, todavía se deben seguir investigando estos complejos mecanismos epigenéticos que hacen de nuestro genoma algo dinámico y cambiante, pues algunos no son bien conocidos del todo. Comprenderlos mejor tendría importantes aplicaciones en el tratamiento y prevención de enfermedades en el futuro.
Artículo editado por Carmen de Jesús Gil.
Artículos que pueden interesarte
- ¿Cómo se descubre la causa genética de una patología?
- Las mutaciones silenciosas: ¿Cómo se generan las proteínas y qué efecto pueden tener sobre ellas?
- No puedo vivir sin ti: los genes esenciales para vivir.
- ¿Podemos jugar a ser dios? La ciencia de crear vida.
Referencias bibliográficas
Bedregal, P., Shand, B., Santos, M. J., Ventura-Juncá, P., (2010). Aportes de la epigenética en la comprensión del desarrollo del ser humano. Rev. Med. Chile, 138: 366-372. https://dx.doi.org/10.4067/S0034-98872010000300018
García, R., Ayala, P., Perdomo, P., (2012). Epigenetics: definition, molecular bases and implications in human health and evolution. Rev. Cienc. Salud, 10 (1): 59-71.
Gonzalo, V., Castellví-bel, S., Balaguer, F., Pellisé, M., Ocaña, T., (2008). Epigenética del cáncer. Servicio de Gastroenterología. Institut de Malalties Digestives i Metabòliques. Hospital Clínic. CIBERehd, 31 (1): 37-45. ISSN 2145-4507
Valladares-Salgado, A., Suárez-Sánchez, F., Burguete-García, A. I., Cruz, M., (2014). Epigenética de la obesidad infantil y de la diabetes. Revista Médica del Instituto Mexicano del Seguro Social, 52 (1): 88-93.